Namenda: Médicament contre la maladie d'Alzheimer
Namenda est un médicament utilisé dans le traitement de la maladie d'Alzheimer. Informations détaillées sur l'utilisation, la posologie, les effets secondaires de Namenda.
Nom de la marque: Namenda
Nom générique: chlorhydrate de mémantine
Namenda (chlorhydrate de mémantine) est un médicament utilisé dans le traitement de la maladie d'Alzheimer. Informations détaillées sur les utilisations, la posologie et les effets secondaires de Namenda ci-dessous.
Contenu:
La description
Pharmacologie
Indications et usage
Contre-indications
Précautions
Interactions médicamenteuses
Effets indésirables
Surdosage
Dosage
Fourni
Instructions aux patients
Information pour les patients de Namenda (en anglais simple)
La description
Namenda® (chlorhydrate de mémantine) est un antagoniste des récepteurs NMDA oralement actif. Le nom chimique du chlorhydrate de mémantine est le chlorhydrate de 1-amino-3,5-diméthyladamantane avec la formule développée suivante:
Source: Forest Laboratories, distributeur américain ou Namenda.
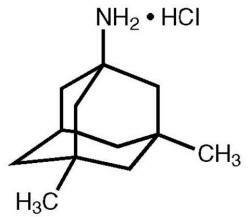
La formule moléculaire est C 12 H 21 N · HCl et le poids moléculaire est 215,76.
Memantine HCl se présente sous la forme d'une fine poudre blanche à blanc cassé et est soluble dans l'eau. Namenda est disponible sous forme de comprimés ou de solution buvable. Namenda est disponible pour une administration orale sous forme de comprimés pelliculés en forme de gélule contenant 5 mg et 10 mg de chlorhydrate de mémantine. Les comprimés contiennent également les ingrédients inactifs suivants: cellulose microcristalline, lactose monohydraté, dioxyde de silicium colloïdal, talc et stéarate de magnésium. De plus, les ingrédients inactifs suivants sont également présents en tant que composants de la pellicule: hypromellose, triacétine, dioxyde de titane, FD&C jaune # 6 et FD&C bleu # 2 (comprimés à 5 mg), oxyde de fer noir (comprimés à 10 mg). La solution buvable de Namenda contient du chlorhydrate de mémantine à une concentration équivalente à 2 mg de chlorhydrate de mémantine dans chaque ml. La solution buvable contient également les ingrédients inactifs suivants: solution de sorbitol (70%), méthylparaben, propylparaben, propylène glycol, glycérine, arôme naturel de menthe poivrée # 104, acide citrique, citrate de sodium et purifié l'eau.
Pharmacologie clinique
Mécanisme d'action et pharmacodynamique
Activation persistante des récepteurs du système nerveux central N-méthyl-D-aspartate (NMDA) par le Le glutamate d'acide aminé excitateur a été supposé contribuer à la symptomatologie de La maladie d'Alzheimer. La mémantine est supposée exercer son effet thérapeutique par son action comme une affinité faible à modérée antagoniste non compétitif (canal ouvert) du récepteur NMDA qui se lie de préférence au récepteur NMDA opéré canaux cationiques. Rien n'indique que la mémantine prévienne ou ralentisse la neurodégénérescence chez les patients atteints de la maladie d'Alzheimer.
La mémantine a montré une affinité faible à négligeable pour les récepteurs GABA, benzodiazépine, dopamine, adrénergique, histamine et glycine et pour les canaux Ca 2+, Na + ou K + dépendants de la tension. La mémantine a également montré des effets antagonistes sur le récepteur 5HT 3 avec une puissance similaire à celle le récepteur NMDA et bloqué les récepteurs nicotiniques de l'acétylcholine avec un sixième à un dixième de la puissance.
Des études in vitro ont montré que la mémantine n'affecte pas l'inhibition réversible de l'acétylcholinestérase par le donépézil, la galantamine ou la tacrine.
Pharmacocinétique
La mémantine est bien absorbée après administration orale et a une pharmacocinétique linéaire sur la plage de doses thérapeutiques. Il est excrété principalement dans l'urine, inchangé, et a une demi-vie d'élimination terminale d'environ 60 à 80 heures.
Absorption et distribution
Après administration orale, la mémantine est fortement absorbée, les concentrations maximales étant atteintes en 3 à 7 heures environ. La nourriture n'a aucun effet sur l'absorption de la mémantine. Le volume moyen de distribution de la mémantine est de 9 à 11 L / kg et la liaison aux protéines plasmatiques est faible (45%).
Métabolisme et élimination
La mémantine subit un métabolisme hépatique partiel. Environ 48% du médicament administré est excrété sous forme inchangée dans l'urine; le reste est converti principalement en trois métabolites polaires qui possèdent un récepteur NMDA minimal activité antagoniste: le conjugué N-glucuronide, la 6-hydroxy mémantine et la 1-nitroso-désaminée mémantine. Un total de 74% de la dose administrée est excrété sous forme de somme du médicament parent et du conjugué N-glucuronide. Le système enzymatique microsomique hépatique CYP450 ne joue pas de rôle significatif dans le métabolisme de la mémantine. La mémantine a une demi-vie d'élimination terminale d'environ 60 à 80 heures. La clairance rénale implique une sécrétion tubulaire active modérée par une réabsorption tubulaire dépendante du pH.
Populations spéciales
Insuffisance rénale: La pharmacocinétique de la mémantine a été évaluée après une administration orale unique de 20 mg de chlorhydrate de mémantine chez 8 sujets présentant une insuffisance rénale légère (clairance de la créatinine, CLcr,> 50 - 80 mL / min), 8 sujets atteints d'insuffisance rénale modérée (CLcr 30 - 49 mL / min), 7 sujets atteints d'insuffisance rénale sévère (CLcr 5 - 29 mL / min) et 8 sujets sains (CLcr> 80 mL / min) appariés aussi étroitement que possible par âge, poids et sexe aux sujets atteints d'insuffisance rénale déficience. L'ASC moyenne 0- (infini) a augmenté de 4%, 60% et 115% chez les sujets atteints d'insuffisance rénale légère, modérée et sévère, respectivement, par rapport aux sujets sains. La demi-vie d'élimination terminale a augmenté de 18%, 41% et 95% chez les sujets atteints d'insuffisance rénale légère, modérée et sévère, respectivement, par rapport aux sujets sains.
Aucun ajustement posologique n'est recommandé chez les patients présentant une insuffisance rénale légère et modérée. La posologie doit être réduite chez les patients présentant une insuffisance rénale sévère (voir POSOLOGIE ET ADMINISTRATION).
Personnes âgées: La pharmacocinétique de Namenda chez les sujets jeunes et âgés est similaire.
Le sexe: Après l'administration de doses multiples de Namenda 20 mg deux fois par jour, les femmes ont été exposées à environ 45% de plus que les hommes, mais il n'y a pas eu de différence d'exposition lorsque le poids corporel a été pris en compte.
Interactions médicament-médicament
Substrats d'enzymes microsomales: Des études in vitro ont indiqué qu'à des concentrations supérieures à celles associées à l'efficacité, la mémantine n'induit pas les isoenzymes du cytochrome P450 CYP1A2, CYP2C9, CYP2E1 et CYP3A4 / 5. De plus, des études in vitro ont montré que la mémantine produit une inhibition minimale des enzymes CYP450 CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 et CYP3A4. Ces données indiquent qu'aucune interaction pharmacocinétique avec des médicaments métabolisés par ces enzymes n'est attendue.
Inhibiteurs des enzymes microsomales: La mémantine subissant un métabolisme minimal, la majorité de la dose étant excrétée sous forme inchangée dans l'urine, une interaction entre la mémantine et les médicaments inhibiteurs des enzymes du CYP450 est peu probable. L'administration concomitante de Namenda avec l'inhibiteur d'AChE donepezil HCl n'affecte pas la pharmacocinétique de l'un ou l'autre composé.
Médicaments éliminés par les mécanismes rénaux: La mémantine est éliminée en partie par la sécrétion tubulaire. Des études in vivo ont montré que plusieurs doses d'hydrochlorothiazide / triamtérène diurétique (HCTZ / TA) n'affectaient pas l'ASC de la mémantine à l'état d'équilibre. La mémantine n'a pas affecté la biodisponibilité de l'AT et a diminué l'ASC et la C max de l'HCTZ d'environ 20%. L'administration concomitante de mémantine avec le médicament antihyperglycémiant Glucovance® (glyburide et metformine HCl) n'a pas affecté la pharmacocinétique de la mémantine, de la metformine et du glyburide. La mémantine n'a pas modifié les effets hypoglycémiants de Glucovance®, ce qui indique l'absence d'interaction pharmacodynamique.
Médicaments qui rendent l'urine alcaline: La clairance de la mémantine a été réduite d'environ 80% dans des conditions d'urine alcaline à pH 8. Par conséquent, les modifications du pH de l'urine vers l'état alcalin peuvent entraîner une accumulation du médicament avec une augmentation possible des effets indésirables. Les médicaments qui alcalinisent l'urine (par exemple, les inhibiteurs de l'anhydrase carbonique, le bicarbonate de sodium) devraient réduire l'élimination rénale de la mémantine.
Médicaments fortement liés aux protéines plasmatiques: La liaison aux protéines plasmatiques de la mémantine étant faible (45%), une interaction avec des médicaments fortement liés aux protéines plasmatiques, comme la warfarine et la digoxine, est peu probable.
ESSAIS CLINIQUES
L'efficacité de Namenda (chlorhydrate de mémantine) comme traitement pour les patients atteints de la maladie d'Alzheimer modérée à sévère a été démontrée chez 2 patients randomisés, Études cliniques à double insu contrôlées par placebo (études 1 et 2) menées aux États-Unis qui ont évalué à la fois la fonction cognitive et la fonction quotidienne. L'âge moyen des patients participant à ces deux essais était de 76 ans avec une fourchette de 50 à 93 ans. Environ 66% des patients étaient des femmes et 91% des patients étaient de race blanche.
Une troisième étude (étude 3), réalisée en Lettonie, a recruté des patients atteints de démence sévère, mais n'a pas évalué la fonction cognitive comme critère d'évaluation planifié.
Mesures des résultats de l'étude: dans chaque étude américaine, l'efficacité de Namenda a été déterminée à l'aide d'un instrument conçu pour évaluer la fonction globale grâce à une évaluation liée aux soignants et un instrument qui mesure cognition. Les deux études ont montré que les patients sous Namenda ont connu une amélioration significative des deux mesures par rapport au placebo.
La fonction quotidienne a été évaluée dans les deux études à l'aide de l'inventaire modifié de l'étude coopérative sur la maladie d'Alzheimer - Activités de la vie quotidienne (ADCS-ADL). L'ADCS-ADL consiste en une batterie complète de questions ADL utilisées pour mesurer les capacités fonctionnelles des patients. Chaque élément ADL est évalué à partir du plus haut niveau de performances indépendantes pour achever la perte. L'investigateur effectue l'inventaire en interrogeant un soignant familier avec le comportement du patient. Un sous-ensemble de 19 articles, y compris des évaluations de la capacité du patient à manger, s'habiller, se baigner, téléphoner, voyager, faire du shopping, et effectuer d'autres tâches ménagères a été validé pour l'évaluation des patients avec modérée à sévère démence. Il s'agit de l'ADCS-ADL modifié, qui a une plage de score de 0 à 54, les scores inférieurs indiquant une plus grande altération fonctionnelle.
La capacité de Namenda à améliorer les performances cognitives a été évaluée dans les deux études avec la batterie pour troubles graves (SIB), un instrument multi-items qui a été validé pour l'évaluation de la fonction cognitive chez les patients avec modéré à sévère démence. Le SIB examine certains aspects de la performance cognitive, y compris les éléments d'attention, d'orientation, de langage, de mémoire, de capacité visuospatiale, de construction, de praxis et d'interaction sociale. La plage de notation SIB est de 0 à 100, avec des scores inférieurs indiquant une plus grande déficience cognitive.
Étude 1 (étude de vingt-huit semaines)
Dans une étude d'une durée de 28 semaines, 252 patients atteints de maladie d'Alzheimer probable modérée à sévère (diagnostiqués par DSM-IV et NINCDS-ADRDA critères, avec des scores au Mini-Mental State Examination> / = 3 et! - = 14 et Global Deterioration Scale Stades 5-6) ont été randomisés à Namenda ou placebo. Pour les patients randomisés à Namenda, le traitement a été initié à 5 mg une fois par jour et augmenté chaque semaine de 5 mg / jour en doses fractionnées jusqu'à une dose de 20 mg / jour (10 mg deux fois par jour).
Effets sur l'ADCS-ADL:
La figure 1 montre le cours du temps pour le changement par rapport à la ligne de base du score ADCS-ADL pour les patients dans les deux groupes de traitement achevant les 28 semaines de l'étude. À 28 semaines de traitement, la différence moyenne des scores de changement ADCS-ADL pour les patients traités par Namenda par rapport aux patients sous placebo était de 3,4 unités. En utilisant une analyse basée sur tous les patients et en reportant leur dernière observation d'étude (analyse LOCF), le traitement par Namenda était statistiquement significativement supérieur au placebo.
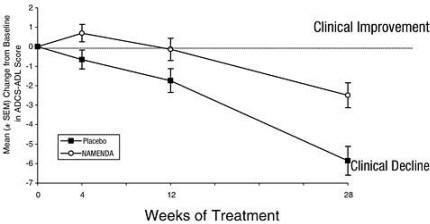
Figure 1: évolution dans le temps du changement par rapport au départ du score ADCS-ADL pour les patients ayant terminé 28 semaines de traitement.
La figure 2 montre les pourcentages cumulés de patients de chacun des groupes de traitement qui avaient atteint au moins le changement de l'ADCS-ADL indiqué sur l'axe X.
Les courbes montrent que les patients assignés à Namenda et au placebo ont une large gamme de réponses et montrent généralement une détérioration (un changement négatif de l'ADCS-ADL par rapport à la référence), mais que le groupe Namenda est plus susceptible de montrer une baisse plus amélioration. (Dans un affichage de distribution cumulative, une courbe pour un traitement efficace serait décalée vers la gauche de la courbe pour placebo, tandis qu'un traitement inefficace ou délétère se superposerait ou se déplacerait vers la droite de la courbe pour placebo.)
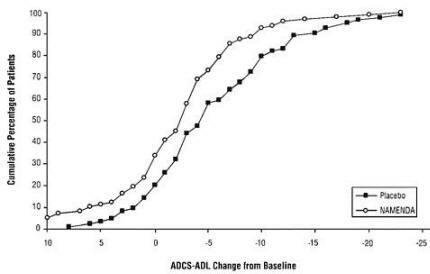
Figure 2: pourcentage cumulé de patients ayant terminé 28 semaines de traitement en double aveugle avec des changements spécifiés par rapport aux valeurs initiales des scores ADCS-ADL.
Effets sur le SIB: La figure 3 montre le cours du temps pour le changement par rapport à la ligne de base du score SIB pour les deux groupes de traitement au cours des 28 semaines de l'étude. À 28 semaines de traitement, la différence moyenne des scores de changement SIB pour les patients traités par Namenda par rapport aux patients sous placebo était de 5,7 unités. En utilisant une analyse LOCF, le traitement par Namenda était statistiquement significativement supérieur au placebo.
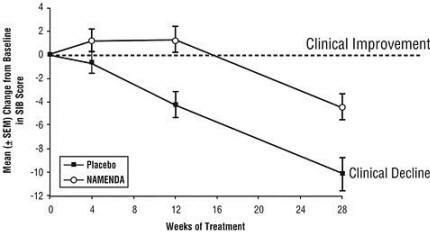
Figure 3: Évolution dans le temps du changement par rapport au départ du score SIB pour les patients ayant terminé 28 semaines de traitement.
La figure 4 montre les pourcentages cumulés de patients de chaque groupe de traitement qui avaient atteint au moins la mesure du changement du score SIB indiqué sur l'axe X.
Les courbes montrent que les patients assignés à Namenda et au placebo ont un large éventail de réponses et montrent généralement une détérioration, mais que le groupe Namenda est plus susceptible de montrer une baisse plus amélioration.
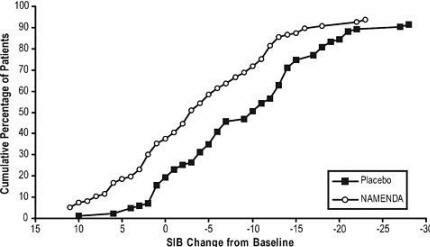
Figure 4: Pourcentage cumulé de patients ayant terminé 28 semaines de traitement en double aveugle avec des changements spécifiés par rapport aux valeurs initiales des scores SIB.
Étude 2 (étude de vingt-quatre semaines) Dans une étude d'une durée de 24 semaines, 404 patients présentant une maladie d'Alzheimer probable (diagnostiquée selon les critères NINCDS-ADRDA, avec mini-examen de l'état mental) scores ≥ 5 et ≤ 14) qui avaient été traités par le donépézil pendant au moins 6 mois et qui avaient reçu une dose stable de donépézil au cours des 3 derniers mois ont été randomisés entre Namenda ou un placebo tout en recevant donépézil. Pour les patients randomisés à Namenda, le traitement a été initié à 5 mg une fois par jour et augmenté chaque semaine de 5 mg / jour en doses fractionnées jusqu'à une dose de 20 mg / jour (10 mg deux fois par jour).
Effets sur l'ADCS-ADL: La figure 5 montre le cours du temps pour le changement par rapport à la ligne de base du score ADCS-ADL pour les deux groupes de traitement au cours des 24 semaines de l'étude. À 24 semaines de traitement, la différence moyenne des scores de changement ADCS-ADL pour Namenda / donepezil patients traités (traitement d'association) par rapport aux patients sous placebo / donépézil (monothérapie) était de 1,6 unités. En utilisant une analyse LOCF, le traitement par Namenda / donepezil était statistiquement significativement supérieur au placebo / donepezil.
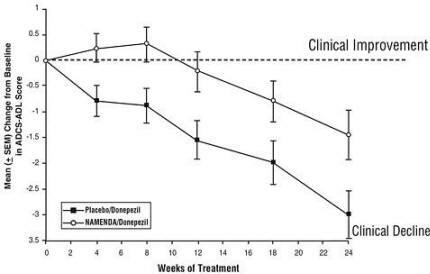
Figure 5: évolution dans le temps du changement par rapport au départ du score ADCS-ADL pour les patients ayant terminé 24 semaines de traitement.
La figure 6 montre les pourcentages cumulés de patients de chacun des groupes de traitement qui avaient atteint au moins la mesure d'amélioration de l'ADCS-ADL indiquée sur l'axe X.
Les courbes montrent que les patients assignés à Namenda / donepezil et au placebo / donepezil ont un large éventail de réponses et montrent généralement une détérioration, mais que le groupe Namenda / donepezil est plus susceptible de montrer une baisse plus amélioration.
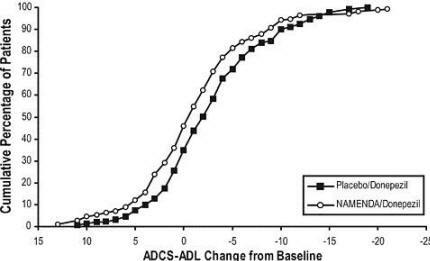
Figure 6: pourcentage cumulé de patients ayant terminé 24 semaines de traitement en double aveugle avec des changements spécifiés par rapport aux valeurs initiales des scores ADCS-ADL.
Effets sur le SIB: La figure 7 montre le cours du temps pour le changement par rapport à la ligne de base du score SIB pour les deux groupes de traitement au cours des 24 semaines de l'étude. À 24 semaines de traitement, la différence moyenne des scores de changement SIB pour les patients traités par Namenda / donepezil par rapport aux patients sous placebo / donepezil était de 3,3 unités. En utilisant une analyse LOCF, le traitement par Namenda / donepezil était statistiquement significativement supérieur au placebo / donepezil.
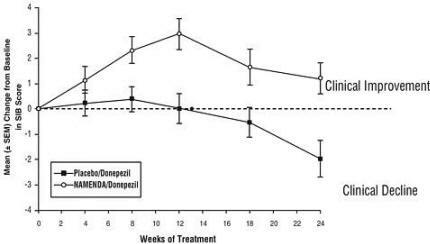
Figure 7: Évolution dans le temps du changement par rapport au départ du score SIB pour les patients ayant terminé 24 semaines de traitement.
La figure 8 montre les pourcentages cumulés de patients de chaque groupe de traitement qui avaient atteint au moins la mesure de l'amélioration du score SIB indiquée sur l'axe X.
Les courbes montrent que les patients assignés à Namenda / donepezil et au placebo / donepezil ont une large gamme réponses, mais que le groupe Namenda / donepezil est plus susceptible de montrer une amélioration ou une déclin.
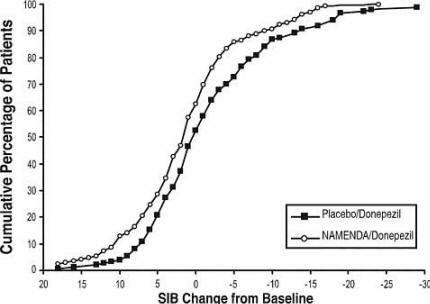
Figure 8: pourcentage cumulé de patients ayant terminé 24 semaines de traitement en double aveugle avec des changements spécifiés par rapport aux valeurs initiales des scores SIB.
Étude 3 (étude de douze semaines) Dans une étude en double aveugle d'une durée de 12 semaines, menée dans des maisons de repos en Lettonie, 166 patients atteints de démence au DSM-III-R, un score au mini-état mental <10 et une échelle globale de détérioration de 5 à 7 ont été randomisés entre Namenda ou placebo. Pour les patients randomisés à Namenda, le traitement a été initié à 5 mg une fois par jour et augmenté à 10 mg une fois par jour après 1 semaine. Les principales mesures d'efficacité étaient la sous-échelle de dépendance aux soins de l'échelle d'évaluation comportementale pour les patients gériatriques (BGP), une mesure de la fonction au jour le jour, et une impression clinique globale du changement (CGI-C), une mesure de effet. Aucune mesure valide de la fonction cognitive n'a été utilisée dans cette étude. Une différence de traitement statistiquement significative à 12 semaines qui favorisait Namenda par rapport au placebo a été observée sur les deux principales mesures d'efficacité. Parce que les patients entrés étaient un mélange de maladie d'Alzheimer et de démence vasculaire, une tentative a été faite pour distinguer les deux groupes et tous les patients ont ensuite été désignés comme souffrant de démence vasculaire ou de maladie d'Alzheimer, en fonction de leurs scores sur l'échelle ischémique de Hachinski à l'étude entrée. Environ 50% seulement des patients avaient une tomographie cérébrale informatisée. Pour le sous-ensemble désigné comme ayant la maladie d'Alzheimer, un effet de traitement statistiquement significatif favorisant Namenda sur le placebo à 12 semaines a été observé à la fois sur le BGP et le CGI-C.
Indications et usage
Namenda (chlorhydrate de mémantine) est indiqué pour le traitement de la démence modérée à sévère de type Alzheimer.
Contre-indications
Namenda (chlorhydrate de mémantine) est contre-indiqué chez les patients présentant une hypersensibilité connue au chlorhydrate de mémantine ou à l'un des excipients utilisés dans la formulation.
Précautions
Information pour les patients et les soignants: Les soignants doivent être informés de l'administration recommandée (deux fois par jour pour les doses supérieures à 5 mg) et de l'escalade de dose (intervalle minimum d'une semaine entre les augmentations de dose).
Crises neurologiques:
Namenda n'a pas été systématiquement évalué chez les patients souffrant d'un trouble convulsif. Dans les essais cliniques de Namenda, des crises se sont produites chez 0,2% des patients traités par Namenda et 0,5% des patients traités par placebo.
Conditions génito-urinaires
Les conditions qui augmentent le pH de l'urine peuvent diminuer l'élimination urinaire de la mémantine entraînant une augmentation des taux plasmatiques de mémantine.
Populations spéciales
Insuffisance hépatique
Namenda subit un métabolisme hépatique partiel, avec environ 48% de la dose administrée excrétée dans l'urine sous forme inchangée ou sous forme de somme du médicament parent et du conjugué N-glucuronide (74%). La pharmacocinétique de la mémantine chez les patients atteints d'insuffisance hépatique n'a pas été étudiée, mais ne devrait être que légèrement affectée.
Insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée. Une réduction de la posologie est recommandée chez les patients présentant une insuffisance rénale sévère (voir PHARMACOLOGIE CLINIQUE et DOSAGE ET ADMINISTRATION ).
Interactions médicament-médicament
N-méthyl-D-aspartate (NMDA) antagonistes: l'utilisation combinée de Namenda avec d'autres antagonistes NMDA (amantadine, kétamine et dextrométhorphane) n'a pas été systématiquement évaluée et cette utilisation doit être envisagée avec prudence.
Effets de Namenda sur les substrats d'enzymes microsomales: Des études in vitro menées avec des substrats marqueurs des enzymes CYP450 (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) ont montré une inhibition minimale de ces enzymes par la mémantine. De plus, des études in vitro indiquent qu'à des concentrations supérieures à celles associées à l'efficacité, la mémantine n'induit pas les isoenzymes CYP1A2, CYP2C9, CYP2E1 et CYP3A4 / 5 du cytochrome P450. Aucune interaction pharmacocinétique avec des médicaments métabolisés par ces enzymes n'est attendue.
Effets des inhibiteurs et / ou des substrats des enzymes microsomales sur Namenda: La mémantine est principalement éliminée par voie rénale, et les médicaments qui sont des substrats et / ou des inhibiteurs du système CYP450 ne devraient pas modifier le métabolisme de la mémantine.
Inhibiteurs de l'acétylcholinestérase (AChE): L'administration concomitante de Namenda avec l'inhibiteur d'AChE donepezil HCl n'a pas affecté la pharmacocinétique de l'un ou l'autre composé. Dans une étude clinique contrôlée de 24 semaines chez des patients atteints de la maladie d'Alzheimer modérée à sévère, les effets Le profil d'événement observé avec une combinaison de mémantine et de donépézil était similaire à celui du donépézil seul.
Médicaments éliminés via les mécanismes rénaux: La mémantine étant éliminée en partie par la sécrétion tubulaire, la co-administration de médicaments utilisant le même système cationique rénal, y compris l'hydrochlorothiazide (HCTZ), le triamtérène (TA), la metformine, la cimétidine, la ranitidine, la quinidine et la nicotine pourraient potentiellement entraîner une altération des taux plasmatiques des deux agents. Cependant, la co-administration de Namenda et de HCTZ / TA n'a pas affecté la biodisponibilité de la mémantine ou de la TA, et la biodisponibilité de HCTZ a diminué de 20%. De plus, la co-administration de mémantine avec le médicament antihyperglycémiant Glucovance® (glyburide et metformine HCl) n'a pas affecté la pharmacocinétique de la mémantine, de la metformine et du glyburide. De plus, la mémantine n'a pas modifié l'effet hypoglycémiant de Glucovance®.
Médicaments qui rendent l'urine alcaline: La clairance de la mémantine a été réduite d'environ 80% dans des conditions d'urine alcaline à pH 8. Par conséquent, les modifications du pH de l'urine vers l'état alcalin peuvent entraîner une accumulation du médicament avec une augmentation possible des effets indésirables. Le pH urinaire est modifié par l'alimentation, les médicaments (par exemple, les inhibiteurs de l'anhydrase carbonique, le bicarbonate de sodium) et l'état clinique du patient (par exemple, l'acidose tubulaire rénale ou les infections sévères des voies urinaires). Par conséquent, la mémantine doit être utilisée avec prudence dans ces conditions.
Carcinogenèse, mutagenèse et altération de la fertilité
Il n'y avait aucun signe de cancérogénicité dans une étude orale de 113 semaines chez la souris à des doses allant jusqu'à 40 mg / kg / jour (10 fois la dose humaine maximale recommandée [MRHD] en mg / m 2). Il n'y avait également aucun signe de cancérogénicité chez les rats ayant reçu par voie orale jusqu'à 40 mg / kg / jour pendant 71 semaines suivi de 20 mg / kg / jour (20 et 10 fois la MRHD en mg / m 2, respectivement) pendant 128 semaines.
La mémantine n'a produit aucun signe de potentiel génotoxique lorsqu'elle a été évaluée in vitro. typhimurium ou E. coli reverse mutation assay, in vitro chromosomal aberration test in human lymphocytes, an vivo cytogenetics assay for chromosome damage in rats, and in vivo mouse micronucleus assay. Les résultats étaient équivoques dans un essai de mutation génique in vitro utilisant des cellules V79 de hamster chinois.
Aucune altération de la fertilité ou de la reproduction n'a été observée chez les rats ayant reçu jusqu'à 18 mg / kg / jour (9 fois la MRHD mg / m 2) par voie orale à partir de 14 jours avant l'accouplement jusqu'à la gestation et la lactation chez les femelles, ou pendant 60 jours avant l'accouplement mâles.
Grossesse
Catégorie de grossesse B: La mémantine administrée par voie orale à des rates et à des lapines gravides pendant la période d'organogenèse n'était pas tératogène jusqu'aux doses les plus élevées testées. (18 mg / kg / jour chez le rat et 30 mg / kg / jour chez le lapin, qui sont respectivement 9 et 30 fois la dose maximale recommandée chez l'homme [MRHD] sur un mg / m 2 base).
Une légère toxicité maternelle, une diminution du poids des petits et une incidence accrue de vertèbres cervicales non ossifiées ont été observées lors d'une dose de 18 mg / kg / jour dans une étude dans laquelle des rats ont reçu de la mémantine par voie orale commençant avant l'accouplement et se poursuivant pendant le post-partum période. Une légère toxicité maternelle et une diminution du poids des petits ont également été observées à cette dose dans une étude dans laquelle des rats ont été traités du 15e jour de gestation à la période post-partum. La dose sans effet pour ces effets était de 6 mg / kg, soit 3 fois la MRHD en mg / m 2.
Il n'y a pas d'études adéquates et bien contrôlées de la mémantine chez les femmes enceintes. La mémantine ne doit être utilisée pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes
On ne sait pas si la mémantine est excrétée dans le lait maternel humain. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, la prudence s'impose lorsque la mémantine est administrée à une mère qui allaite.
Utilisation pédiatrique
Il n'y a pas d'essais adéquats et bien contrôlés documentant l'innocuité et l'efficacité de la mémantine dans toute maladie survenant chez les enfants.
Effets indésirables
L'expérience décrite dans cette section découle d'études menées auprès de patients atteints de la maladie d'Alzheimer et de démence vasculaire.
Événements indésirables menant à l'arrêt: Dans les essais contrôlés contre placebo dans lesquels des patients atteints de démence ont reçu des doses de Namenda allant jusqu'à 20 mg / jour, la probabilité d'arrêt du traitement en raison d'un événement indésirable était la même dans le groupe Namenda que dans le groupe placebo groupe. Aucun événement indésirable individuel n'a été associé à l'arrêt du traitement chez 1% ou plus des patients traités par Namenda et à un taux supérieur à celui du placebo.
Événements indésirables signalés dans les essais contrôlés: Les événements indésirables rapportés dans les essais de Namenda (chlorhydrate de mémantine) reflètent l'expérience acquise dans des conditions étroitement surveillées dans une population de patients hautement sélectionnés. Dans la pratique réelle ou dans d'autres essais cliniques, ces estimations de fréquence peuvent ne pas s'appliquer, car les conditions d'utilisation, le comportement de déclaration et les types de patients traités peuvent différer. Le tableau 1 répertorie les signes et les symptômes liés au traitement qui ont été signalés chez au moins 2% des patients dans les essais sur la démence et pour lesquels le taux de survenue était plus élevé pour les patients traités par Namenda que pour ceux traités par placebo. Aucun événement indésirable ne s'est produit à une fréquence d'au moins 5% et deux fois le taux de placebo.
Système de corps |
Placebo (N = 922) % |
Namenda (N = 940) % |
Corps dans son ensemble | ||
Fatigue |
1 | 2 |
Douleur |
1 | 3 |
Système cardiovasculaire | ||
Hypertension |
2 | 4 |
Système nerveux central et périphérique | ||
Vertiges |
5 | 7 |
Mal de crâne |
3 | 6 |
Système digestif | ||
Constipation |
3 | 5 |
Vomissement |
2 | 3 |
Système musculo-squelettique | ||
Mal au dos |
2 | 3 |
Troubles psychiatriques | ||
Confusion |
5 | 6 |
Somnolence |
2 | 3 |
Hallucination |
2 | 3 |
Système respiratoire | ||
Tousser |
3 | 4 |
Dyspnée |
1 | 2 |
Les autres événements indésirables survenus avec une incidence d'au moins 2% chez les patients traités par Namenda mais à un taux supérieur ou égal sous placebo ont été l'agitation, la chute, les blessures infligées, l'incontinence urinaire, diarrhée, bronchite, insomnie, infection des voies urinaires, symptômes pseudo-grippaux, démarche anormale, dépression, infection des voies respiratoires supérieures, anxiété, œdème périphérique, nausées, anorexie et arthralgie.
Le profil global des événements indésirables et les taux d'incidence des événements indésirables individuels dans la sous-population de patients la maladie d'Alzheimer modérée à sévère n'était pas différente du profil et des taux d'incidence décrits ci-dessus pour la démence globale population.
Changements des signes vitaux: Les groupes Namenda et placebo ont été comparés en ce qui concerne (1) la variation moyenne par rapport à la valeur initiale des signes vitaux (pouls, tension artérielle systolique, sang diastolique pression et le poids) et (2) l'incidence de patients répondant aux critères de changements potentiellement cliniquement significatifs par rapport à variables. Il n'y a eu aucun changement cliniquement important des signes vitaux chez les patients traités par Namenda. Une comparaison des mesures des signes vitaux en décubitus dorsal et debout pour Namenda et le placebo chez les sujets âgés normaux a indiqué que le traitement par Namenda n'est pas associé à des changements orthostatiques.
Changements de laboratoire: Les groupes Namenda et placebo ont été comparés en ce qui concerne (1) le changement moyen par rapport à la ligne de base dans diverses chimies sériques, hématologie et variables d'analyse d'urine et (2) l'incidence de patients répondant aux critères de changements potentiellement cliniquement significatifs par rapport à variables. Ces analyses n'ont révélé aucun changement cliniquement important dans les paramètres des tests de laboratoire associés au traitement par Namenda.
Modifications de l'ECG: Les groupes Namenda et placebo ont été comparés en ce qui concerne (1) la variation moyenne par rapport à la ligne de base de divers paramètres ECG et (2) l'incidence de patients répondant aux critères de changements potentiellement cliniquement significatifs par rapport à variables. Ces analyses n'ont révélé aucun changement cliniquement important des paramètres ECG associés au traitement par Namenda.
Autres événements indésirables observés au cours des essais cliniques
Namenda a été administré à environ 1 350 patients atteints de démence, dont plus de 1 200 ont reçu la dose maximale recommandée de 20 mg / jour. Les patients ont reçu un traitement par Namenda pendant des périodes allant jusqu'à 884 jours, 862 patients ayant reçu au moins 24 semaines de traitement et 387 patients ayant reçu 48 semaines ou plus de traitement.
Signes et symptômes émergents du traitement qui se sont produits au cours de 8 essais cliniques contrôlés et de 4 en ouvert Les essais cliniques ont été enregistrés comme événements indésirables par les investigateurs cliniques en utilisant leur propre terminologie. choisir. Pour fournir une estimation globale de la proportion de personnes ayant des types d'événements similaires, les événements ont été regroupés dans un plus petit nombre de catégories normalisées en utilisant la terminologie de l'OMS, et les fréquences des événements ont été calculées études.
Tous les événements indésirables survenus chez au moins deux patients sont inclus, à l'exception de ceux déjà répertoriés dans le tableau 1, termes OMS également générale pour être informative, symptômes ou événements mineurs peu susceptibles d'être causés par le médicament, par exemple, car ils sont courants dans l'étude population. Les événements sont classés par système corporel et répertoriés en utilisant les définitions suivantes: événements indésirables fréquents - ceux qui surviennent chez au moins 1/100 patients; événements indésirables peu fréquents - ceux survenus chez 1/100 à 1/1000 patients. Ces événements indésirables ne sont pas nécessairement liés au traitement par Namenda et, dans la plupart des cas, ont été observés à une fréquence similaire chez les patients sous placebo dans les études contrôlées.
Corps dans son ensemble: Fréquent: syncope. Peu fréquents: hypothermie, réaction allergique.
Système cardiovasculaire: Fréquent: insuffisance cardiaque. Peu fréquents: angine de poitrine, bradycardie, infarctus du myocarde, thrombophlébite, fibrillation auriculaire, hypotension, arrêt cardiaque, hypotension orthostatique, embolie pulmonaire, œdème pulmonaire.
Système nerveux central et périphérique: Fréquent: crise ischémique transitoire, accident vasculaire cérébral, vertige, ataxie, hypokinésie. Peu fréquents: paresthésie, convulsions, trouble extrapyramidal, hypertonie, tremblements, aphasie, hypoesthésie, anormal coordination, hémiplégie, hyperkinésie, contractions musculaires involontaires, stupeur, hémorragie cérébrale, névralgie, ptose, neuropathie.
Système digestif: Peu fréquents: gastro-entérite, diverticulite, hémorragie gastro-intestinale, méléna, ulcération œsophagienne.
Troubles hémiques et lymphatiques: Fréquent: anémie. Peu fréquent: leucopénie.
Troubles métaboliques et nutritionnels: Fréquent: augmentation de la phosphatase alcaline et diminution du poids. Peu fréquents: déshydratation, hyponatrémie, aggravation du diabète sucré.
Troubles psychiatriques: Fréquent: réaction agressive. Peu fréquents: délire, trouble de la personnalité, labilité émotionnelle, nervosité, trouble du sommeil, augmentation de la libido, psychose, amnésie, apathie, réaction paranoïde, pensées anormales, pleurs anormaux, augmentation de l'appétit, paronirie, délire, dépersonnalisation, névrose, suicide tentative.
Système respiratoire: Fréquent: pneumonie. Peu fréquents: apnée, asthme, hémoptysie.
Peau et annexes: Fréquent: éruption cutanée. Peu fréquents: ulcération cutanée, prurit, cellulite, eczéma, dermatite, éruption érythémateuse, alopécie, urticaire.
Sens spéciaux: Fréquent: cataracte, conjonctivite. Peu fréquents: dégénérescence de la macula lutea, diminution de l'acuité visuelle, diminution de l'audition, acouphènes, blépharite, vision trouble, opacité cornéenne, glaucome, hémorragie conjonctivale, douleur oculaire, hémorragie rétinienne, xérophtalmie, diplopie, larmoiement anormal, myopie, décollement de la rétine.
Système urinaire: Fréquent: miction fréquente. Peu fréquents: dysurie, hématurie, rétention urinaire.
Événements signalés à la suite de la commercialisation de Namenda, aux États-Unis et hors États-Unis
Bien qu'aucune relation causale avec le traitement par la mémantine n'ait été trouvée, les événements indésirables suivants ont été rapportés comme étant temporairement associés au traitement par la mémantine et ne sont pas décrits ailleurs dans l'étiquetage: bloc auriculo-ventriculaire, fracture osseuse, syndrome du canal carpien, infarctus cérébral, douleur thoracique, claudication, colite, dyskinésie, dysphagie, gastrite, reflux gastro-œsophagien, convulsions grand mal, hémorragie intracrânienne, insuffisance hépatique, hyperlipidémie, hypoglycémie, iléus, impuissance, malaise, syndrome malin des neuroleptiques, aigu pancréatite, pneumonie par aspiration, insuffisance rénale aiguë, intervalle QT prolongé, agitation, syndrome de Stevens-Johnson, mort subite, tachycardie supraventriculaire, tachycardie, tardive dyskinésie et thrombocytopénie.
TOXICOLOGIE ANIMALE
Lésions neuronales induites par la mémantine (vacuolisation et nécrose) dans les cellules multipolaires et pyramidales des couches corticales III et IV de la partie postérieure néocortex cingulaire et rétrosplénial chez le rat, semblables à ceux qui sont connus pour se produire chez les rongeurs auxquels on a administré d'autres antagonistes des récepteurs NMDA. Des lésions ont été observées après une seule dose de mémantine. Dans une étude dans laquelle des rats ont reçu des doses orales quotidiennes de mémantine pendant 14 jours, la dose sans effet pour la nécrose neuronale était de 6 fois la dose humaine maximale recommandée sur une base de mg / m 2. Le potentiel d'induction de vacuolisation neuronale centrale et de nécrose par des antagonistes des récepteurs NMDA chez l'homme est inconnu.
ABUS DE DROGUES ET DÉPENDANCE
Classe de substances contrôlées: Memantine HCl n'est pas une substance contrôlée.
Dépendance physique et psychologique: Le mémantine HCl est un antagoniste non compétitif de NMDA d'affinité faible à modérée qui n'a produit aucun signe de recherche de drogue comportement ou symptômes de sevrage à l'arrêt chez 2 504 patients ayant participé à des essais cliniques à des fins thérapeutiques doses. Les données post-commercialisation, en dehors des États-Unis, collectées rétrospectivement, n'ont fourni aucune preuve d'abus ou de dépendance à la drogue.
Surdosage
Étant donné que les stratégies de prise en charge du surdosage sont en constante évolution, il est conseillé de contacter un centre antipoison pour déterminer les dernières recommandations pour la gestion d'une surdose de tout drogue.
Comme dans tous les cas de surdosage, des mesures de soutien générales doivent être utilisées et le traitement doit être symptomatique. L'élimination de la mémantine peut être améliorée par l'acidification de l'urine. Dans un cas documenté de surdosage contenant jusqu'à 400 mg de mémantine, le patient a souffert d'agitation, de psychose, d'hallucinations visuelles, de somnolence, de stupeur et de perte de conscience. Le patient s'est rétabli sans séquelles permanentes.
Dosage et administration
La posologie de Namenda (chlorhydrate de mémantine) qui s'est avérée efficace dans les essais cliniques contrôlés est de 20 mg / jour.
La dose initiale recommandée de Namenda est de 5 mg une fois par jour. La dose cible recommandée est de 20 mg / jour. La dose doit être augmentée par paliers de 5 mg à 10 mg / jour (5 mg deux fois par jour), 15 mg / jour (5 mg et 10 mg en doses séparées) et 20 mg / jour (10 mg deux fois par jour). L'intervalle minimum recommandé entre les augmentations de dose est d'une semaine.
Namenda peut être pris avec ou sans nourriture.
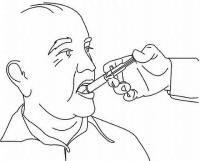
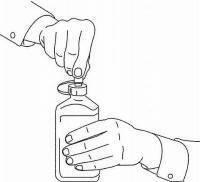
Les patients / soignants doivent être informés de l'utilisation du dispositif de dosage de la solution orale Namenda. Ils doivent être informés de la fiche d'instructions du patient jointe au produit. Les patients / soignants doivent être invités à adresser toute question sur l'utilisation de la solution à leur médecin ou leur pharmacien.
Doses dans des populations particulières
Une dose cible de 5 mg deux fois par jour est recommandée chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine de 5 à 29 ml / min sur la base de l'équation de Cockroft-Gault):
Pour les hommes: CLcr = [140-âge (ans)] · Poids (kg) / [72 · créatinine sérique (mg / dL)]
Pour les femelles: CLcr = 0,85 · [140 ans (ans)] · Poids (kg) / [72 · créatinine sérique (mg / dL)]
Comment fournie
Comprimé à 5 mg:
Bouteille de 60 NDC # 0456-3205-60
10 × 10 doses unitaires NDC # 0456-3205-63
Les comprimés pelliculés en forme de gélules sont bruns, avec la force (5) gravée d'un côté et FL de l'autre.
Comprimé à 10 mg:
Bouteille de 60 NDC # 0456-3210-60
10 × 10 doses unitaires NDC # 0456-3210-63
Les comprimés pelliculés en forme de gélules sont gris, avec la force (10) gravée d'un côté et FL de l'autre.
Titration Pak:
Emballage blister en PVC / aluminium contenant 49 comprimés. Comprimés de 28 × 5 mg et de 21 × 10 mg. NDC # 0456-3200-14
Les comprimés pelliculés de 5 mg en forme de gélule sont bronzés, avec la force (5) gravée d'un côté et FL de l'autre. Les comprimés pelliculés de 10 mg en forme de gélule sont gris, avec la force (10) gravée d'un côté et FL de l'autre.
Solution orale:
Les recommandations posologiques pour la solution buvable sont les mêmes que celles des comprimés. La solution buvable est claire, sans alcool, sans sucre et aromatisée à la menthe poivrée.
Solution orale à 2 mg / ml (10 mg = 5 ml)
12 fl. oz. (360 ml) bouteille NDC # 0456-3202-12
Conserver à 25 ° C (77 ° F); excursions permises à 15-30 ° C (59-86 ° F) [voir USP Controlled Room Temperature].
Forest Pharmaceuticals, Inc.
Filiale de Forest Laboratories, Inc.
Saint-Louis, MO 63045
Sous licence de Merz Pharmaceuticals GmbH
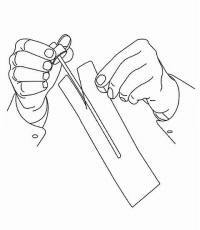
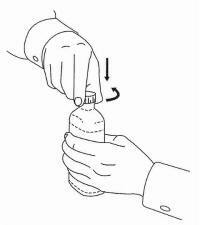
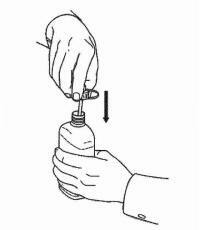
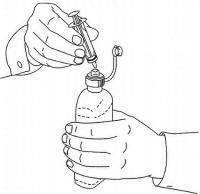
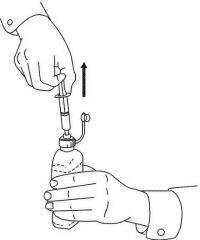
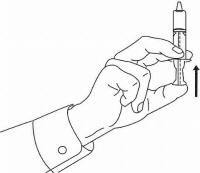
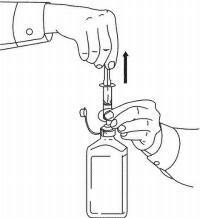
INSTRUCTIONS AUX PATIENTS POUR LA SOLUTION ORALE NAMENDA®
Suivez les instructions ci-dessous pour utiliser votre dispositif de dosage de solution buvable Namenda®.
IMPORTANT: lisez ces instructions avant d'utiliser la solution orale Namenda®.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
IMPORTANT: Les informations contenues dans cette monographie ne sont pas destinées à couvrir toutes les utilisations, directions, précautions, interactions médicamenteuses ou effets indésirables possibles. Ces informations sont généralisées et ne sont pas destinées à un avis médical spécifique. Si vous avez des questions sur les médicaments que vous prenez ou si vous souhaitez plus d'informations, consultez votre médecin, votre pharmacien ou votre infirmière. Dernière mise à jour le 4/07.
La source: Forest Laboratories, distributeur américain de Namenda.
Information pour les patients de Namenda (en anglais simple)
retour à: Page d'accueil de Pharmacologie des médicaments psychiatriques



