NovoLog pour le traitement du diabète
Nom de la marque: NovoLog
Nom générique: insuline aspart
Forme posologique: injection
Contenu:
Indications et usage
Dosage et administration
Formes posologiques et Strengts
Contre-indications
Avertissements et precautions
Effets indésirables
Interactions médicamenteuses
Utilisation dans des populations spécifiques
Surdosage
La description
Pharmacologie clinique
Toxicologie non clinique
Etudes cliniques
Comment fournis / stockage et manutention
NovoLog, insuline asparte, informations destinées aux patients (en anglais simple)
Indications et usage
Traitement du diabète sucré
NovoLog est un analogue de l'insuline indiqué pour améliorer le contrôle glycémique chez les adultes et les enfants atteints de diabète sucré.
Haut
Dosage et administration
Dosage
NovoLog est un analogue de l'insuline dont l'action débute plus tôt que l'insuline humaine ordinaire. La posologie de NovoLog doit être personnalisée. NovoLog administré par injection sous-cutanée doit généralement être utilisé dans les régimes avec une insuline à action intermédiaire ou à longue durée [voir
Avertissements et precautions, Comment fournis / stockage et manutention]. Les besoins quotidiens totaux en insuline peuvent varier et se situent généralement entre 0,5 et 1,0 unités / kg / jour. Lorsqu'il est utilisé dans un régime de traitement par injection sous-cutanée liée aux repas, 50 à 70% de l'insuline totale Les exigences peuvent être fournies par NovoLog et le reste par un intermédiaire ou insuline à action prolongée. En raison du début relativement rapide de NovoLog et de la courte durée de l'activité hypoglycémiante, certains patients peuvent avoir besoin de plus insuline basale et plus d'insuline totale pour prévenir l'hyperglycémie pré-repas lors de l'utilisation de NovoLog que lors de l'utilisation régulière humaine insuline.N'utilisez pas NovoLog visqueux (épaissi) ou trouble; utiliser uniquement s'il est clair et incolore. NovoLog ne doit pas être utilisé après la date d'expiration imprimée.
Injection sous-cutanée
NovoLog doit être administré par injection sous-cutanée dans la région abdominale, les fesses, la cuisse ou le haut du bras. Parce que NovoLog a un début plus rapide et une durée d'activité plus courte que l'insuline régulière humaine, elle doit être injectée immédiatement (dans les 5 à 10 minutes) avant un repas. Les sites d'injection doivent être tournés dans la même région pour réduire le risque de lipodystrophie. Comme pour toutes les insulines, la durée d'action de NovoLog variera en fonction de la dose, du site d'injection, du débit sanguin, de la température et du niveau d'activité physique.
NovoLog peut être dilué avec du milieu de dilution d'insuline pour NovoLog pour injection sous-cutanée. La dilution d'une partie de NovoLog dans neuf parties de diluant donnera une concentration un dixième de celle de NovoLog (équivalente à U-10). La dilution d'une partie de NovoLog dans une partie de diluant donnera une concentration deux fois plus faible que NovoLog (équivalente à U-50).
Perfusion d'insuline sous-cutanée continue (CSII) par pompe externe
NovoLog peut également être perfusé par voie sous-cutanée par une pompe à insuline externe [voir Avertissements et precautions, Comment fournis / stockage et manutention]. L'insuline diluée ne doit pas être utilisée dans les pompes à insuline externes. Parce que NovoLog a un début plus rapide et une durée d'activité plus courte que l'insuline humaine ordinaire, les bolus pré-repas de NovoLog doivent être perfusés immédiatement (dans les 5 à 10 minutes) avant un repas. Les sites de perfusion doivent être tournés dans la même région pour réduire le risque de lipodystrophie. La programmation initiale de la pompe à perfusion d'insuline externe doit être basée sur la dose quotidienne totale d'insuline du schéma précédent. Bien qu'il existe une variabilité interpatiente importante, environ 50% de la dose totale est généralement administrée sous forme de bolus de NovoLog liés aux repas et le reste est administré sous forme de perfusion basale. Changer le NovoLog dans le réservoir, les kits de perfusion et le site d'insertion du kit de perfusion au moins toutes les 48 heures.
Utilisation intraveineuse
NovoLog peut être administré par voie intraveineuse sous contrôle médical pour le contrôle glycémique avec une surveillance étroite de la glycémie et des taux de potassium pour éviter l'hypoglycémie et l'hypokaliémie [voir Avertissements et precautions, Comment fournis / stockage et manutention]. Pour une utilisation intraveineuse, NovoLog doit être utilisé à des concentrations de 0,05 U / mL à 1,0 U / mL d'insuline asparte dans les systèmes de perfusion utilisant des poches de perfusion en polypropylène. NovoLog s'est révélé stable dans les liquides de perfusion tels que le chlorure de sodium à 0,9%.
Inspectez NovoLog à la recherche de particules et de décoloration avant l'administration parentérale.
Haut
Formes posologiques et Strengts
NovoLog est disponible dans les formats d'emballage suivants: chaque présentation contient 100 unités d'insuline asparte par ml (U-100).
- Flacons de 10 ml
- Cartouches PenFill de 3 ml pour le dispositif de distribution de cartouches PenFill de 3 ml (avec ou sans l'ajout d'un NovoPen® 3 PenMate®) avec des aiguilles jetables NovoFine®
- 3 ml de seringue préremplie NovoLog FlexPen
Haut
Contre-indications
NovoLog est contre-indiqué
- lors d'épisodes d'hypoglycémie
- chez les patients présentant une hypersensibilité à NovoLog ou à l'un de ses excipients.
Haut
Avertissements et precautions
Administration
NovoLog a un début d'action plus rapide et une durée d'activité plus courte que l'insuline humaine ordinaire. Une injection de NovoLog doit être immédiatement suivie d'un repas dans les 5 à 10 minutes. En raison de la courte durée d'action de NovoLog, une insuline à action plus longue doit également être utilisée chez les patients atteints de diabète de type 1 et peut également être nécessaire chez les patients atteints de diabète de type 2. La surveillance du glucose est recommandée pour tous les patients diabétiques et est particulièrement importante pour les patients utilisant une thérapie par perfusion par pompe externe.
Toute modification de la dose d'insuline doit être effectuée avec prudence et uniquement sous surveillance médicale. Le passage d'un produit d'insuline à un autre ou la modification de la force d'insuline peut entraîner la nécessité d'un changement de posologie. Comme pour toutes les préparations d'insuline, la durée d'action de NovoLog peut varier selon les individus ou à différents moments dans le même individu et dépend de nombreuses conditions, y compris le site d'injection, l'approvisionnement en sang local, la température et l'activité physique. Les patients qui modifient leur niveau d'activité physique ou leur plan de repas peuvent nécessiter un ajustement des doses d'insuline. Les besoins en insuline peuvent être modifiés en cas de maladie, de troubles émotionnels ou d'autres stress.
Les patients utilisant une thérapie par pompe à perfusion d'insuline sous-cutanée continue doivent être formés pour administrer l'insuline par injection et disposer d'une insulinothérapie alternative en cas de défaillance de la pompe.
Hypoglycémie
L'hypoglycémie est l'effet indésirable le plus courant de tous les traitements à l'insuline, y compris NovoLog. Une hypoglycémie sévère peut entraîner une perte de conscience et / ou des convulsions et peut entraîner une altération temporaire ou permanente de la fonction cérébrale ou la mort. Hypoglycémie sévère nécessitant l'assistance d'une autre personne et / ou une perfusion parentérale de glucose ou l'administration de glucagon a été observée dans des essais cliniques avec l'insuline, y compris des essais NovoLog.
Le moment de l'hypoglycémie reflète généralement le profil d'action temporelle des formulations d'insuline administrées [voir Pharmacologie Clincal]. D'autres facteurs tels que les changements dans l'apport alimentaire (par exemple, la quantité de nourriture ou le moment des repas), le site d'injection, l'exercice et les médicaments concomitants peuvent également modifier le risque d'hypoglycémie [voir Interactions médicamenteuses]. Comme pour toutes les insulines, faites preuve de prudence chez les patients souffrant d'hypoglycémie inconsciente et chez les patients qui peuvent être prédisposés à l'hypoglycémie (par exemple, les patients à jeun ou dont l'apport alimentaire est irrégulier). La capacité du patient à se concentrer et à réagir peut être altérée en raison d'une hypoglycémie. Cela peut présenter un risque dans des situations où ces capacités sont particulièrement importantes, telles que la conduite ou l'utilisation d'autres machines.
Des changements rapides du taux de glucose sérique peuvent induire des symptômes d'hypoglycémie chez les personnes atteintes de diabète, quelle que soit la valeur du glucose. Les symptômes d'alerte précoce de l'hypoglycémie peuvent être différents ou moins prononcés dans certaines conditions, telles que diabète de longue date, maladie du nerf diabétique, utilisation de médicaments tels que les bêta-bloquants ou diabète intensifié contrôle [voir Interactions médicamenteuses]. Ces situations peuvent entraîner une hypoglycémie sévère (et, éventuellement, une perte de conscience) avant que le patient ne soit conscient de l'hypoglycémie. L'insuline administrée par voie intraveineuse a un début d'action plus rapide que l'insuline administrée par voie sous-cutanée, nécessitant une surveillance plus étroite de l'hypoglycémie.
Hypokaliémie
Tous les produits d'insuline, y compris NovoLog, provoquent un déplacement du potassium de l'espace extracellulaire vers l'espace intracellulaire, conduisant éventuellement à une hypokaliémie qui, si elle n'est pas traitée, peut provoquer une paralysie respiratoire, une arythmie ventriculaire et décès. Faites preuve de prudence chez les patients pouvant présenter un risque d'hypokaliémie (par exemple, les patients qui utilisent des médicaments hypolipémiants, les patients prendre des médicaments sensibles aux concentrations sériques de potassium et les patients recevant une insuline).
Insuffisance rénale
Comme pour les autres insulines, les exigences posologiques de NovoLog peuvent être réduites chez les patients présentant une insuffisance rénale [voir Pharmacologie clinique].
Insuffisance hépatique
Comme pour les autres insulines, les exigences posologiques de NovoLog peuvent être réduites chez les patients présentant une insuffisance hépatique [voir Pharmacologie clinique].
Hypersensibilité et réactions allergiques
Réactions locales - Comme pour toute autre insulinothérapie, les patients peuvent présenter des rougeurs, des gonflements ou des démangeaisons au site d'injection de NovoLog. Ces réactions disparaissent généralement en quelques jours à quelques semaines, mais dans certains cas, il peut être nécessaire d'arrêter NovoLog. Dans certains cas, ces réactions peuvent être liées à des facteurs autres que l'insuline, tels que des irritants dans un agent nettoyant pour la peau ou une mauvaise technique d'injection. Des réactions localisées et des myalgies généralisées ont été signalées avec le métacrésol injecté, qui est un excipient de NovoLog.
Réactions systémiques - Une allergie généralisée grave, menaçant le pronostic vital, y compris l'anaphylaxie, peut survenir avec tout produit d'insuline, y compris NovoLog. Des réactions anaphylactiques avec NovoLog ont été rapportées après approbation. Une allergie généralisée à l'insuline peut également provoquer une éruption cutanée sur tout le corps (y compris le prurit), une dyspnée, une respiration sifflante, une hypotension, une tachycardie ou une diaphorèse. Dans les essais cliniques contrôlés, des réactions allergiques ont été rapportées chez 3 des 735 patients (0,4%) traités avec de l'insuline humaine régulière et 10 des 1394 patients (0,7%) traités avec NovoLog. Dans les essais cliniques contrôlés et non contrôlés, 3 des 2341 (0,1%) patients traités par NovoLog ont abandonné en raison de réactions allergiques.
Production d'anticorps
Des augmentations des titres d'anticorps anti-insuline qui réagissent à la fois avec l'insuline humaine et l'insuline asparte ont été observées chez des patients traités par NovoLog. Des augmentations des anticorps anti-insuline sont observées plus fréquemment avec NovoLog qu'avec l'insuline humaine ordinaire. Les données d'un essai contrôlé de 12 mois chez des patients atteints de diabète de type 1 suggèrent que l'augmentation de ces anticorps est transitoire et que les différences dans les niveaux d'anticorps entre les groupes d'insuline humaine régulière et d'insuline asparte observés à 3 et 6 mois n'étaient plus évidents à 12 mois. La signification clinique de ces anticorps n'est pas connue. Ces anticorps ne semblent pas provoquer de détérioration du contrôle glycémique ni nécessiter d'augmentation de la dose d'insuline.
Mélange d'insulines
- Le mélange de NovoLog avec de l'insuline humaine NPH immédiatement avant l'injection atténue le pic de concentration de NovoLog, sans affecter de manière significative le délai de concentration maximale ni la biodisponibilité NovoLog. Si NovoLog est mélangé avec de l'insuline humaine NPH, NovoLog doit d'abord être aspiré dans la seringue et le mélange doit être injecté immédiatement après le mélange.
- L'efficacité et l'innocuité du mélange de NovoLog avec des préparations d'insuline produites par d'autres fabricants n'ont pas été étudiées.
- Les mélanges d'insuline ne doivent pas être administrés par voie intraveineuse.
Perfusion d'insuline sous-cutanée continue par pompe externe
Lorsqu'il est utilisé dans une pompe à perfusion d'insuline sous-cutanée externe, NovoLog ne doit pas être mélangé à une autre insuline ou diluant. Lorsque vous utilisez NovoLog dans une pompe à insuline externe, les informations spécifiques à NovoLog doivent être suivies (par exemple, la durée d'utilisation, fréquence de changement des kits de perfusion) car les informations spécifiques à NovoLog peuvent différer du manuel général de la pompe instructions.
Des dysfonctionnements de la pompe ou du kit de perfusion ou une dégradation de l'insuline peuvent entraîner une hyperglycémie et une cétose rapides en raison du petit dépôt sous-cutané d'insuline. Cela est particulièrement pertinent pour les analogues de l'insuline à action rapide qui sont absorbés plus rapidement par la peau et ont une durée d'action plus courte. Une identification et une correction rapides de la cause de l'hyperglycémie ou de la cétose sont nécessaires. Un traitement provisoire avec injection sous-cutanée peut être nécessaire [voir Dosage et administration, Avertissements et precautions, et Comment fournis / stockage et manutention].
NovoLog est recommandé pour une utilisation dans des systèmes de pompe adaptés à la perfusion d'insuline, comme indiqué ci-dessous.
Pompes:
Série MiniMed 500 et autres pompes équivalentes.
Réservoirs et kits de perfusion:
NovoLog est recommandé pour une utilisation dans les réservoirs et les kits de perfusion compatibles avec l'insuline et la pompe spécifique. Des études in vitro ont montré qu'un dysfonctionnement de la pompe, une perte de métacrésol et une dégradation de l'insuline peuvent se produire lorsque NovoLog est maintenu dans un système de pompe pendant plus de 48 heures. Les réservoirs et les kits de perfusion doivent être changés au moins toutes les 48 heures.
NovoLog ne doit pas être exposé à des températures supérieures à 37 ° C (98,6 ° F). NovoLog qui sera utilisé dans une pompe ne doit pas être mélangé avec une autre insuline ou avec un diluant [voir Dosage et administration, Avertissements et precautions, et Comment fournis / stockage et manutention].
Haut
Effets indésirables
Expérience d'essai clinique
Étant donné que les essais cliniques sont menés selon des conceptions très différentes, les taux d'effets indésirables rapportés dans un essai clinique peuvent ne pas être facilement comparé aux taux rapportés dans un autre essai clinique, et peut ne pas refléter les taux réellement observés en clinique entraine toi.
- Hypoglycémie
L'hypoglycémie est l'effet indésirable le plus fréquemment observé chez les patients utilisant de l'insuline, y compris NovoLog [voir Avertissements et precautions].
- Initiation à l'insuline et intensification du contrôle du glucose
Une intensification ou une amélioration rapide du contrôle glycémique a été associée à un transitoire réversible trouble de réfraction ophtalmologique, aggravation de la rétinopathie diabétique et périphérique douloureux aigu neuropathie. Cependant, le contrôle glycémique à long terme diminue le risque de rétinopathie diabétique et de neuropathie.
- Lipodystrophie
L'utilisation à long terme d'insuline, y compris NovoLog, peut provoquer une lipodystrophie au site d'injections ou de perfusions répétées d'insuline. La lipodystrophie comprend la lipohypertrophie (épaississement du tissu adipeux) et la lipoatrophie (amincissement du tissu adipeux) et peut affecter l'absorption d'insuline. Faire pivoter les sites d'injection ou de perfusion d'insuline dans la même région pour réduire le risque de lipodystrophie.
- Gain de poids
Une prise de poids peut survenir avec certains traitements à l'insuline, dont NovoLog, et a été attribuée aux effets anabolisants de l'insuline et à la diminution de la glucosurie.
- Œdème périphérique
L'insuline peut provoquer une rétention de sodium et un œdème, en particulier si un contrôle métabolique auparavant médiocre est amélioré par une insulinothérapie intensifiée.
- Fréquences des effets indésirables des médicaments
Les fréquences des effets indésirables au cours des essais cliniques de NovoLog chez les patients atteints de diabète sucré de type 1 et de diabète sucré de type 2 sont répertoriées dans les tableaux ci-dessous.
Tableau 1: Événements indésirables liés au traitement chez les patients atteints de diabète sucré de type 1 (événements indésirables avec une fréquence de ‰ ¥ 5% et survenant plus fréquemment avec NovoLog que l’insuline régulière humaine sont répertorié)
|
NovoLog + NPH N = 596 |
Insuline humaine régulière + NPH N = 286 |
|||
| Terme préféré | N | (%) | N | (%) |
| Hypoglycémie * | 448 | 75% | 205 | 72% |
| Mal de crâne | 70 | 12% | 28 | 10% |
| Blessure accidentelle | 65 | 11% | 29 | 10% |
| La nausée | 43 | 7% | 13 | 5% |
| La diarrhée | 28 | 5% | 9 | 3% |
* L'hypoglycémie est définie comme un épisode de concentration de glucose dans le sang
Tableau 2: Événements indésirables liés au traitement chez les patients atteints de diabète sucré de type 2 (sauf pour l'hypoglycémie, les événements indésirables avec une fréquence de â ¥ 5% et survenant plus fréquemment avec NovoLog que l'insuline humaine régulière sont répertorié)
|
NovoLog + NPH N = 91 |
Insuline humaine régulière + NPH N = 91 |
|||
| N | (%) | N | (%) | |
| Hypoglycémie * | 25 | 27% | 33 | 36% |
| Hyporeflexie | 10 | 11% | 6 | 7% |
| Onychomycose | 9 | 10% | 5 | 5% |
| Perturbation sensorielle | 8 | 9% | 6 | 7% |
| Infection urinaire | 7 | 8% | 6 | 7% |
| Douleur de poitrine | 5 | 5% | 3 | 3% |
| Mal de crâne | 5 | 5% | 3 | 3% |
| Troubles de la peau | 5 | 5% | 2 | 2% |
| Douleur abdominale | 5 | 5% | 1 | 1% |
| Sinusite | 5 | 5% | 1 | 1% |
* L'hypoglycémie est définie comme un épisode de concentration de glucose dans le sang
Données post-commercialisation
Les effets indésirables supplémentaires suivants ont été identifiés lors de l'utilisation post-approbation de NovoLog. Étant donné que ces effets indésirables sont signalés volontairement par une population de taille incertaine, il n'est généralement pas possible d'estimer de manière fiable leur fréquence. Des erreurs de médication dans lesquelles d'autres insulines ont été accidentellement substituées à NovoLog ont été identifiées lors de l'utilisation après approbation.
Haut
Interactions médicamenteuses
Un certain nombre de substances affectent le métabolisme du glucose et peuvent nécessiter un ajustement de la dose d'insuline et en particulier une surveillance étroite.
- Voici des exemples de substances qui peuvent augmenter l'effet hypoglycémiant et la sensibilité à l'hypoglycémie: produits antidiabétiques oraux, pramlintide, ECA inhibiteurs, disopyramide, fibrates, fluoxétine, inhibiteurs de la monoamine oxydase (MAO), propoxyphène, salicylates, analogue de la somatostatine (p. ex. octréotide), sulfonamide antibiotiques.
- Voici des exemples de substances qui peuvent réduire l'effet hypoglycémiant: corticostéroïdes, niacine, danazol, diurétiques, agents sympathomimétiques (par exemple, épinéphrine, salbutamol, terbutaline), isoniazide, dérivés de la phénothiazine, somatropine, hormones thyroïdiennes, œstrogènes, progestatifs (p. ex. dans les contraceptifs oraux), atypiques antipsychotiques.
- Les bêta-bloquants, la clonidine, les sels de lithium et l'alcool peuvent potentialiser ou affaiblir l'effet hypoglycémiant de l'insuline.
- La pentamidine peut provoquer une hypoglycémie, qui peut parfois être suivie d'une hyperglycémie.
- Les signes d'hypoglycémie peuvent être réduits ou absents chez les patients prenant des produits sympatholytiques tels que les bêta-bloquants, la clonidine, la guanéthidine et la réserpine.
Haut
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B. Toutes les grossesses présentent un risque de fond d'anomalies congénitales, de perte ou d'autres résultats indésirables, quelle que soit l'exposition au médicament. Ce risque de fond est accru dans les grossesses compliquées d'hyperglycémie et peut être diminué avec un bon contrôle métabolique. Il est essentiel pour les patientes atteintes de diabète ou ayant des antécédents de diabète gestationnel de maintenir un bon contrôle métabolique avant la conception et tout au long de la grossesse. Les besoins en insuline peuvent diminuer au cours du premier trimestre, augmenter généralement au cours des deuxième et troisième trimestres et diminuer rapidement après l'accouchement. Une surveillance attentive du contrôle de la glycémie est essentielle chez ces patients. Par conséquent, les patientes doivent être avisées d'informer leur médecin si elles ont l'intention de devenir ou si elles tombent enceintes pendant qu'elles prennent NovoLog.
Une étude randomisée en ouvert a comparé l'innocuité et l'efficacité de NovoLog (n = 157) à l'insuline humaine ordinaire (n = 165) chez 322 femmes enceintes atteintes de diabète de type 1. Les deux tiers des patientes inscrites étaient déjà enceintes lors de leur entrée dans l'étude. Étant donné que seulement un tiers des patientes étaient inscrites avant la conception, l'étude n'était pas suffisamment importante pour évaluer le risque de malformations congénitales. Les deux groupes ont atteint une HbA1c moyenne d'environ 6% pendant la grossesse, et il n'y avait pas de différence significative dans l'incidence de l'hypoglycémie maternelle.
Des études de reproduction sous-cutanée et de tératologie ont été réalisées avec NovoLog et l'insuline humaine régulière chez le rat et le lapin. Dans ces études, NovoLog a été administré à des rats femelles avant l'accouplement, pendant l'accouplement et tout au long de la gestation, ainsi qu'aux lapines pendant l'organogenèse. Les effets de NovoLog ne diffèrent pas de ceux observés avec l'insuline humaine régulière sous-cutanée. NovoLog, comme l'insuline humaine, a provoqué des pertes avant et après implantation et des anomalies viscérales / squelettiques chez le rat à une dose de 200 U / kg / jour (environ 32 fois la sous-cutanée humaine dose de 1,0 U / kg / jour, basée sur U / surface corporelle) et chez le lapin à une dose de 10 U / kg / jour (environ trois fois la dose sous-cutanée humaine de 1,0 U / kg / jour, basée sur U / surface du corps zone). Les effets sont probablement secondaires à l'hypoglycémie maternelle à fortes doses. Aucun effet significatif n'a été observé chez le rat à une dose de 50 U / kg / jour et chez le lapin à une dose de 3 U / kg / jour. Ces doses représentent environ 8 fois la dose sous-cutanée humaine de 1,0 U / kg / jour pour les rats et égales à la dose sous-cutanée humaine de 1,0 U / kg / jour pour les lapins, sur la base de la surface U / du corps.
Mères allaitantes
On ne sait pas si l'insuline aspart est excrétée dans le lait maternel. L'utilisation de NovoLog est compatible avec l'allaitement, mais les femmes atteintes de diabète qui allaitent peuvent nécessiter des ajustements de leurs doses d'insuline.
Utilisation pédiatrique
NovoLog est approuvé pour une utilisation chez les enfants pour les injections quotidiennes sous-cutanées et pour la perfusion continue sous-cutanée par pompe à insuline externe. Veuillez consulter la section ETUDES CLINIQUES pour les résumés des études cliniques.
Utilisation gériatrique
Sur le nombre total de patients (n = 1 375) traités par NovoLog dans 3 études cliniques contrôlées, 2,6% (n = 36) étaient âgés de 65 ans ou plus. La moitié de ces patients avaient un diabète de type 1 (18/1285) et l'autre moitié avait un diabète de type 2 (18/90). La réponse de l'HbA1c à NovoLog, par rapport à l'insuline humaine, ne diffère pas selon l'âge, en particulier chez les patients atteints de diabète de type 2. Des études supplémentaires dans des populations plus importantes de patients âgés de 65 ans ou plus sont nécessaires pour permettre des conclusions concernant l'innocuité de NovoLog chez les personnes âgées par rapport aux patients plus jeunes. Aucune étude pharmacocinétique / pharmacodynamique n'a été réalisée pour évaluer l'effet de l'âge sur le début de l'action de NovoLog.
Haut
Surdosage
Une administration excessive d'insuline peut provoquer une hypoglycémie et, en particulier lorsqu'elle est administrée par voie intraveineuse, une hypokaliémie. Les épisodes légers d'hypoglycémie peuvent généralement être traités avec du glucose oral. Des ajustements de la posologie du médicament, des modes de repas ou de l'exercice peuvent être nécessaires. Des épisodes plus graves avec coma, convulsions ou troubles neurologiques peuvent être traités avec du glucagon intramusculaire / sous-cutané ou du glucose intraveineux concentré. Un apport et une observation continus de glucides peuvent être nécessaires car l'hypoglycémie peut réapparaître après une guérison clinique apparente. L'hypokaliémie doit être corrigée de manière appropriée.
Haut
La description
NovoLog (injection d'insuline asparte [origine de l'ADNr]) est un analogue d'insuline humaine à action rapide utilisé pour abaisser la glycémie. NovoLog est homologue à l’insuline humaine ordinaire à l’exception d’une seule substitution de l’aminoacide proline par l'acide aspartique en position B28, et est produit par la technologie de l'ADN recombinant en utilisant Saccharomyces cerevisiae (boulanger Levure). L'insuline aspart a la formule empirique C256H381N65079S6 et un poids moléculaire de 5825,8.

Figure 1. Formule structurelle de l'insuline asparte.
NovoLog est une solution stérile, aqueuse, limpide et incolore, qui contient de l'insuline asparte 100 unités / ml, de la glycérine 16 mg / ml, du phénol 1,50 mg / ml, métacrésol 1,72 mg / ml, zinc 19,6 mcg / ml, hydrogénophosphate disodique dihydraté 1,25 mg / ml et chlorure de sodium 0,58 mg / mL. NovoLog a un pH de 7,2 à 7,6. De l'acide chlorhydrique à 10% et / ou de l'hydroxyde de sodium à 10% peuvent être ajoutés pour ajuster le pH.
Haut
Pharmacologie clinique
Mécanisme d'action
L'activité principale de NovoLog est la régulation du métabolisme du glucose. Les insulines, dont NovoLog, se lient aux récepteurs de l'insuline des cellules musculaires et adipeuses et abaissent la glycémie en facilitant l'absorption cellulaire du glucose et inhibant simultanément la production de glucose du foie.
Pharmacodynamique
Des études chez des volontaires normaux et des patients diabétiques ont montré que l'administration sous-cutanée de NovoLog a un début d'action plus rapide que l'insuline humaine ordinaire.
Dans une étude chez des patients atteints de diabète de type 1 (n = 22), l'effet hypoglycémiant maximal de NovoLog s'est produit entre 1 et 3 heures après l'injection sous-cutanée (voir figure 2). La durée d'action de NovoLog est de 3 à 5 heures. La durée d'action de l'insuline et des analogues de l'insuline tels que NovoLog peut varier considérablement d'un individu à l'autre ou au sein d'un même individu. Les paramètres de l'activité de NovoLog (heure de début, heure de pointe et durée) tels que désignés dans la figure 2 ne doivent être considérés que comme des lignes directrices générales. Le taux d'absorption d'insuline et de début d'activité est affecté par le site d'injection, l'exercice et d'autres variables [voir Avertissements et precautions].
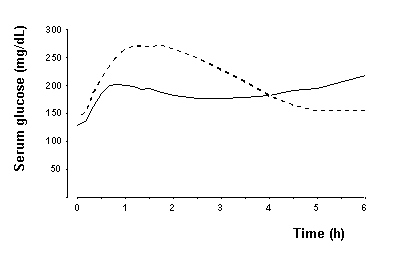
Figure 2. Glycémie moyenne en série collectée jusqu'à 6 heures après une dose unique de NovoLog avant le repas (courbe continue) ou d'insuline humaine ordinaire (courbe hachurée) injectée immédiatement avant un repas chez 22 patients atteints de type 1 Diabète.
Une étude croisée à double insu, randomisée et à double sens chez 16 patients atteints de diabète de type 1 a démontré que la la perfusion de NovoLog a entraîné un profil de glycémie similaire à celui après une perfusion intraveineuse de insuline. NovoLog ou l'insuline humaine a été perfusée jusqu'à ce que la glycémie du patient diminue à 36 mg / dL, ou jusqu'à ce que le patient signes d'hypoglycémie (augmentation de la fréquence cardiaque et début de transpiration), définis comme le temps de la réaction autonome (R) (voir figure 3).
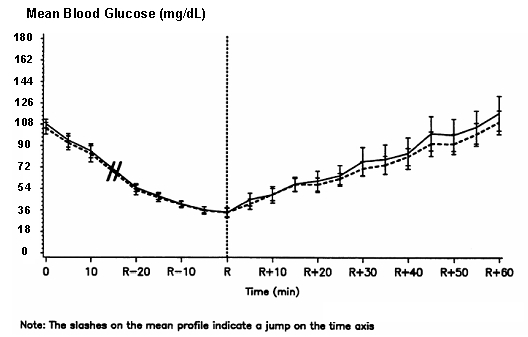
Figure 3. Glucose sérique moyenne après perfusion intraveineuse de NovoLog (courbe hachurée) et d'insuline humaine régulière (courbe continue) chez 16 patients atteints de diabète de type 1. R représente le temps de la réaction autonome.
Pharmacocinétique
La seule substitution de la proline, un acide aminé, par de l'acide aspartique en position B28 dans NovoLog réduit la tendance de la molécule à former des hexamères, comme observé avec l'insuline humaine ordinaire. NovoLog est donc absorbé plus rapidement après l'injection sous-cutanée que l'insuline humaine ordinaire.
Dans une étude croisée randomisée, en double aveugle, 17 sujets sains de sexe masculin de race blanche entre 18 et 40 ans l'âge a reçu une perfusion intraveineuse de NovoLog ou d'insuline humaine ordinaire à 1,5 mU / kg / min pendant 120 minutes. La clairance moyenne de l'insuline était similaire pour les deux groupes avec des valeurs moyennes de 1,2 l / h / kg pour le groupe NovoLog et de 1,2 l / h / kg pour le groupe insuline humaine régulière.
Biodisponibilité et absorption - NovoLog a une absorption plus rapide, un début d'action plus rapide et un durée d'action plus courte que l'insuline humaine ordinaire après injection sous-cutanée (voir Figure 2 et Figure 4). La biodisponibilité relative de NovoLog par rapport à l'insuline humaine ordinaire indique que les deux insulines sont absorbées dans une mesure similaire.

Figure 4. Concentration d'insuline sans sérum moyenne en série collectée jusqu'à 6 heures après une dose pré-repas unique de NovoLog (courbe continue) ou d'insuline humaine ordinaire (courbe hachurée) injectée immédiatement avant un repas chez 22 patients de type 1 Diabète.
Dans les études menées sur des volontaires sains (total n = l07) et des patients atteints de diabète de type 1 (total n = 40), NovoLog a constamment atteint des concentrations sériques maximales environ deux fois plus rapides que les humains normaux insuline. Le temps médian jusqu'à la concentration maximale dans ces essais était de 40 à 50 minutes pour NovoLog contre 80 à 120 minutes pour l'insuline humaine ordinaire. Dans un essai clinique chez des patients atteints de diabète de type 1, NovoLog et de l'insuline humaine ordinaire, tous deux administrés par voie sous-cutanée à une dose de 0,15 U / kg de poids corporel, a atteint des concentrations maximales moyennes de 82 et 36 mU / L, respectivement. Les caractéristiques pharmacocinétiques / pharmacodynamiques de l'insuline aspart n'ont pas été établies chez les patients atteints de diabète de type 2.
La variabilité intra-individuelle dans le temps jusqu'à la concentration maximale d'insuline sérique chez les volontaires sains de sexe masculin était significativement moindre pour NovoLog que pour l'insuline humaine ordinaire. La signification clinique de cette observation n'a pas été établie.
Dans une étude clinique chez des sujets sains non obèses, les différences pharmacocinétiques entre NovoLog et l'insuline humaine décrite ci-dessus a été observée indépendamment du site d'injection (abdomen, cuisse ou bras).
Distribution et élimination - NovoLog a une faible liaison aux protéines plasmatiques (<10%), similaire à celle observée avec l'insuline humaine ordinaire. Après administration sous-cutanée chez des volontaires masculins normaux (n = 24), NovoLog a été éliminé plus rapidement que insuline humaine régulière avec une demi-vie apparente moyenne de 81 minutes contre 141 minutes pour l'homme ordinaire insuline.
Populations spécifiques
Enfants et adolescents - Les propriétés pharmacocinétiques et pharmacodynamiques de NovoLog et de l'insuline humaine ordinaire ont été évaluées dans une étude à dose unique chez 18 enfants (6-12 ans, n = 9) et adolescents (13-17 ans [grade Tanner> 2], n = 9) de type 1 Diabète. Les différences relatives de pharmacocinétique et de pharmacodynamique chez les enfants et les adolescents atteints de diabète de type 1 entre NovoLog et l'insuline humaine régulière étaient similaires à ceux observés chez des sujets adultes en bonne santé et des adultes de type 1. Diabète.
Sexe - Chez les volontaires sains, aucune différence dans les niveaux d'insuline aspart n'a été observée entre les hommes et les femmes lorsque les différences de poids corporel ont été prises en compte. Aucune différence significative d'efficacité n'a été notée (évaluée par l'HbAlc) entre les sexes dans un essai chez des patients atteints de diabète de type 1.
Obésité - Une dose sous-cutanée unique de 0,1 U / kg de NovoLog a été administrée dans une étude portant sur 23 patients atteints de diabète de type 1 et un large éventail d'indices de masse corporelle (IMC, 22 à 39 kg / m2). Les paramètres pharmacocinétiques, ASC et Cmax, de NovoLog n'étaient généralement pas affectés par l'IMC dans les différents groupes - IMC 19-23 kg / m2 (N = 4); IMC 23-27 kg / m2 (N = 7); IMC 27-32 kg / m2 (N = 6) et IMC> 32 kg / m2 (N = 6). La clairance de NovoLog a été réduite de 28% chez les patients avec un IMC> 32 kg / m2 par rapport aux patients avec un IMC
Insuffisance rénale - Certaines études sur l'insuline humaine ont montré une augmentation des taux d'insuline circulante chez les patients atteints d'insuffisance rénale. Une seule dose sous-cutanée de 0,08 U / kg de NovoLog a été administrée dans une étude à des sujets ayant une clairance de la créatinine (CLcr) normale (N = 6) (> 80 ml / min) ou légère (N = 7; CLcr = 50-80 ml / min), modéré (N = 3; CLcr = 30-50 ml / min) ou sévère (mais ne nécessitant pas d'hémodialyse) (N = 2; CLcr = Avertissements et précautions].
Insuffisance hépatique - Certaines études sur l'insuline humaine ont montré une augmentation des taux d'insuline circulante chez les patients insuffisants hépatiques. Une dose sous-cutanée unique de 0,06 U / kg de NovoLog a été administrée dans une étude en ouvert à dose unique de 24 sujets (N = 6 / groupe) avec différents degré d'insuffisance hépatique (légère, modérée et sévère) ayant des scores de Child-Pugh allant de 0 (volontaires sains) à 12 (hépatique sévère) déficience). Dans cette petite étude, il n'y avait aucune corrélation entre le degré d'insuffisance hépatique et tout paramètre pharmacocinétique NovoLog. Une surveillance attentive du glucose et des ajustements de la dose d'insuline, y compris NovoLog, peuvent être nécessaires chez les patients atteints de dysfonction hépatique [voir Avertissements et precautions].
L'effet de l'âge, de l'origine ethnique, de la grossesse et du tabagisme sur la pharmacocinétique et la pharmacodynamique de NovoLog n'a pas été étudié.
Haut
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude de cancérogénicité standard sur 2 ans chez l'animal n'a été réalisée pour évaluer le potentiel cancérogène de NovoLog. Dans des études de 52 semaines, des rats Sprague-Dawley ont reçu une dose sous-cutanée de NovoLog à 10, 50 et 200 U / kg / jour (environ 2, 8 et 32 fois la dose sous-cutanée humaine de 1,0 U / kg / jour, sur la base de la surface U / du corps, respectivement). À une dose de 200 U / kg / jour, NovoLog a augmenté l'incidence des tumeurs des glandes mammaires chez les femmes par rapport aux témoins non traités. L'incidence des tumeurs mammaires pour NovoLog n'était pas significativement différente de celle de l'insuline humaine ordinaire. La pertinence de ces résultats pour l'homme n'est pas connue. NovoLog n’a pas été génotoxique dans les tests suivants: test d’Ames, test de mutation génique sur cellules de lymphome de souris, périphérique humain test d'aberration des chromosomes des lymphocytes sanguins, test in vivo du micronoyau chez la souris et test ex vivo UDS dans le foie de rat hépatocytes. Dans les études de fertilité sur des rats mâles et femelles, à des doses sous-cutanées allant jusqu'à 200 U / kg / jour (environ 32 fois la dose sous-cutanée humaine, sur la base de la surface U / du corps), aucun effet négatif direct sur la fertilité des mâles et des femelles, ni sur les performances reproductives générales des animaux n'a été observé.
Toxicologie animale et / ou pharmacologie
Dans les tests biologiques standard chez la souris et le lapin, une unité de NovoLog a le même effet hypoglycémiant qu'une unité d'insuline humaine ordinaire. Chez l'homme, l'effet de NovoLog est plus rapide à l'apparition et de plus courte durée, par rapport à l'insuline humaine ordinaire, en raison de son absorption plus rapide après injection sous-cutanée (voir rubrique PHARMACOLOGIE CLINIQUE Figure 2 et figure 4).
Haut
Etudes cliniques
Injections quotidiennes sous-cutanées
Deux études ouvertes, contrôlées par active, d'une durée de six mois, ont été menées pour comparer l'innocuité et l'efficacité de NovoLog à Novolin R chez des patients adultes atteints de diabète de type 1. Étant donné que les deux plans d'étude et les résultats étaient similaires, les données ne sont présentées que pour une seule étude (voir le tableau 3). NovoLog a été administré par injection sous-cutanée immédiatement avant les repas et l'insuline humaine ordinaire a été administrée par injection sous-cutanée 30 minutes avant les repas. L'insuline NPH a été administrée comme insuline basale en doses quotidiennes uniques ou fractionnées. Changements dans l'HbA1c et les taux d'incidence d'hypoglycémie sévère (tels que déterminés à partir du nombre d'événements nécessitant l'intervention d'un tiers étaient comparables pour les deux schémas thérapeutiques de cette étude (tableau 3) ainsi que dans les autres études cliniques citées dans ce section. Aucune acidocétose diabétique n'a été signalée dans aucune des études chez l'adulte dans les deux groupes de traitement.
Tableau 3. Administration sous-cutanée de NovoLog dans le diabète de type 1 (24 semaines; n = 882)
| NovoLog + NPH | Novolin R + NPH | |
| N | 596 | 286 |
| HbA de base1c (%)* | 7.9 ±1.1 | 8.0 ± 1.2 |
| Changement par rapport à l'HbA de base1c (%) | -0.1 ± 0.8 | 0.0 ± 0.8 |
| Différence de traitement en HbA1c, Moyenne (intervalle de confiance à 95%) | -0.2 (-0.3, -0.1) | |
| Dose d'insuline de base (UI / kg / 24 heures) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Dose d'insuline de fin d'étude (UI / kg / 24 heures) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Patients souffrant d'hypoglycémie sévère (n,%) â € | 104 (17%) | 54 (19%) |
|
Poids corporel de base (kg) * Changement de poids par rapport à la ligne de base (kg) * |
75.3 ± 14.5 0.5 ± 3.3 |
75.9 ± 13.1 0.9 ± 2.9 |
* Les valeurs sont moyennes ± ET
«Une hypoglycémie sévère fait référence à une hypoglycémie associée à des symptômes du système nerveux central et nécessitant l'intervention d'une autre personne ou une hospitalisation.
Une étude de 24 semaines en groupe parallèle d'enfants et d'adolescents atteints de diabète de type 1 (n = 283) âgés de 6 à 18 ans années a comparé deux schémas de traitement sous-cutané à doses multiples: NovoLog (n = 187) ou Novolin R (n = 96). L'insuline NPH a été administrée comme insuline basale. NovoLog a atteint un contrôle glycémique comparable à Novolin R, tel que mesuré par le changement de l'HbA1c (tableau 4) et les deux groupes de traitement avaient une incidence comparable d'hypoglycémie. L'administration sous-cutanée de NovoLog et d'insuline humaine régulière a également été comparée chez des enfants atteints de diabète de type 1 (n = 26) âgés de 2 à 6 ans ayant des effets similaires sur l'HbA1c et l'hypoglycémie.
Tableau 4. Administration sous-cutanée pédiatrique de NovoLog dans le diabète de type 1 (24 semaines; n = 283)
| NovoLog + NPH | Novolin R + NPH | |
| N | 187 | 96 |
| HbA de base1c (%) * | 8.3 ± 1.2 | 8.3 ± 1.3 |
| Changement par rapport à l'HbA de base1c (%) | 0.1 ± 1.0 | 0.1 ± 1.1 |
| Différence de traitement en HbA1c, Moyenne (intervalle de confiance à 95%) | 0.1 (-0.5, 0.1) | |
| Dose d'insuline de base (UI / kg / 24 heures) * | 0.4 ± 0.2 | 0.6 ± 0.2 |
| Dose d'insuline de fin d'étude (UI / kg / 24 heures) * | 0.4 ± 0.2 | 0.7 ± 0.2 |
| Patients souffrant d'hypoglycémie sévère (n,%) â € | 11 (6%) | 9 (9%) |
| Acidocétose diabétique (n,%) | 10 (5%) | 2 (2%) |
|
Poids corporel de base (kg) * Changement de poids par rapport à la ligne de base (kg) * |
50.6 ± 19.6 2.7 ± 3.5 |
48.7 ± 15.8 2.4 ± 2.6 |
* Les valeurs sont moyennes ± ET
«Une hypoglycémie sévère fait référence à une hypoglycémie associée à des symptômes du système nerveux central et nécessitant l'intervention d'une autre personne ou une hospitalisation.
Une étude de six mois, ouverte et contrôlée par contrôle actif a été menée pour comparer l'innocuité et l'efficacité de NovoLog à Novolin R chez les patients atteints de diabète de type 2 (tableau 5). NovoLog a été administré par injection sous-cutanée immédiatement avant les repas et l'insuline humaine ordinaire a été administrée par injection sous-cutanée 30 minutes avant les repas. L'insuline NPH a été administrée comme insuline basale en doses quotidiennes uniques ou fractionnées. Les changements dans l'HbAlc et les taux d'hypoglycémie sévère (tels que déterminés à partir du nombre d'événements nécessitant l'intervention d'un tiers) étaient comparables pour les deux schémas thérapeutiques.
Tableau 5. Administration sous-cutanée de NovoLog dans le diabète de type 2 (6 mois; n = 176)
| NovoLog + NPH | Novolin R + NPH | |
| N | 90 | 86 |
| HbA de base1c (%) * | 8.1 ± 1.2 | 7.8 ± 1.1 |
| Changement par rapport à l'HbA de base1c (%) | -0.3 ± 1.0 | -0.1 ± 0.8 |
| Différence de traitement en HbA1c, Moyenne (intervalle de confiance à 95%) | - 0.1 (-0.4, -0.1) | |
| Dose d'insuline de base (UI / kg / 24 heures) * | 0.6 ± 0.3 | 0.6 ± 0.3 |
| Dose d'insuline de fin d'étude (UI / kg / 24 heures) * | 0.7 ± 0.3 | 0.7 ± 0.3 |
| Patients souffrant d'hypoglycémie sévère (n,%) â € | 9 (10%) | 5 (8%) |
|
Poids corporel de base (kg) * Changement de poids par rapport à la ligne de base (kg) * |
88.4 ± 13.3 1.2 ± 3.0 |
85.8 ± 14.8 0.4 ± 3.1 |
* Les valeurs sont moyennes ± ET
«Une hypoglycémie sévère fait référence à une hypoglycémie associée à des symptômes du système nerveux central et nécessitant l'intervention d'une autre personne ou une hospitalisation.
Perfusion d'insuline sous-cutanée continue (CSII) par pompe externe
Deux études de conception parallèle ouvertes (6 semaines [n = 29] et 16 semaines [n = 118]) ont comparé NovoLog à un tampon ordinaire insuline humaine (Velosulin) chez les adultes atteints de diabète de type 1 recevant une perfusion sous-cutanée avec une insuline externe pompe. Les deux schémas thérapeutiques ont présenté des variations comparables de l'HbA1c et des taux d'hypoglycémie sévère.
Tableau 6. Étude de la pompe à insuline chez l'adulte dans le diabète de type 1 (16 semaines; n = 118)
| NovoLog | Insuline humaine tamponnée | |
| N | 59 | 59 |
| HbA de base1c (%) * | 7.3 ± 0.7 | 7.5 ± 0.8 |
| Changement par rapport à l'HbA de base1c (%) | 0.0 ± 0.5 | 0.2 ± 0.6 |
| Différence de traitement en HbA1c, Moyenne (intervalle de confiance à 95%) | 0.3 (-0.1, 0.4) | |
| Dose d'insuline de base (UI / kg / 24 heures) * | 0.7 ± 0.8 | 0.6 ± 0.2 |
| Dose d'insuline de fin d'étude (UI / kg / 24 heures) * | 0.7 ± 0.7 | 0.6 ± 0.2 |
| Patients souffrant d'hypoglycémie sévère (n,%) â € | 1 (2%) | 2 (3%) |
|
Poids corporel de base (kg) * Changement de poids par rapport à la ligne de base (kg) * |
77.4 ± 16.1 0.1 ± 3.5 |
74.8 ± 13.8 -0.0 ± 1.7 |
* Les valeurs sont moyennes ± ET
«Une hypoglycémie sévère fait référence à une hypoglycémie associée à des symptômes du système nerveux central et nécessitant l'intervention d'une autre personne ou une hospitalisation.
Une étude randomisée, ouverte, de conception parallèle, sur 16 semaines, d'enfants et d'adolescents atteints de diabète de type 1 (n = 298) âgés de 4 à 18 ans années ont comparé deux schémas de perfusion sous-cutanée administrés via une pompe à insuline externe: NovoLog (n = 198) ou insuline lispro (n = 100). Ces deux traitements ont entraîné des changements comparables par rapport à la valeur initiale de l'HbA1c et des taux comparables d'hypoglycémie après 16 semaines de traitement (voir le tableau 7).
Tableau 7. Étude pédiatrique de la pompe à insuline dans le diabète de type 1 (16 semaines; n = 298)
| NovoLog | Lispro | |
| N | 198 | 100 |
| HbA de base1c (%) * | 8.0 ± 0.9 | 8.2 ± 0.8 |
| Changement par rapport à l'HbA de base1c (%) | -0.1 ± 0.8 | -0.1 ± 0.7 |
| Différence de traitement en HbA1c, Moyenne (intervalle de confiance à 95%) | -0.1 (-0.3, 0.1) | |
| Dose d'insuline de base (UI / kg / 24 heures) * | 0.9 ± 0.3 | 0.9 ± 0.3 |
| Dose d'insuline de fin d'étude (UI / kg / 24 heures) * | 0.9 ± 0.2 | 0.9 ± 0.2 |
| Patients souffrant d'hypoglycémie sévère (n,%) â € | 19 (10%) | 8 (8%) |
| Acidocétose diabétique (n,%) | 1 (0.5%) | 0 (0) |
|
Poids corporel de base (kg) * Changement de poids par rapport à la ligne de base (kg) * |
54.1 ± 19.7 1.8 ± 2.1 |
55.5 ± 19.0 1.6 ± 2.1 |
* Les valeurs sont moyennes ± ET
«Une hypoglycémie sévère fait référence à une hypoglycémie associée à des symptômes du système nerveux central et nécessitant l'intervention d'une autre personne ou une hospitalisation.
Un essai de conception parallèle ouvert de 16 semaines a comparé l'injection pré-prandiale de NovoLog en conjonction avec Injections de NPH à NovoLog administrées par perfusion sous-cutanée continue chez 127 adultes de type 2 Diabète. Les deux groupes de traitement ont présenté des réductions similaires de l'HbA1c et des taux d'hypoglycémie sévère (tableau 8) [voir Indications et usage, Dosage et administration, Avertissements et precautions et Comment fournis / stockage et manutention].
Tableau 8. Thérapie par pompe dans le diabète de type 2 (16 semaines; n = 127)
| Pompe NovoLog | NovoLog + NPH | |
| N | 66 | 61 |
| HbA de base1c (%) * | 8.2 ± 1.4 | 8.0 ± 1.1 |
| Changement par rapport à l'HbA de base1c (%) | -0.6 ± 1.1 | -0.5 ± 0.9 |
| Différence de traitement en HbA1c, Moyenne (intervalle de confiance à 95%) | 0.1 (0.4, 0.3) | |
| Dose d'insuline de base (UI / kg / 24 heures) * | 0.7 ± 0.3 | 0.8 ± 0.5 |
| Dose d'insuline de fin d'étude (UI / kg / 24 heures) * | 0.9 ± 0.4 | 0.9 ± 0.5 |
|
Poids corporel de base (kg) * Changement de poids par rapport à la ligne de base (kg) * |
96.4 ± 17.0 1.7 ± 3.7 |
96.9 ± 17.9 0.7 ± 4.1 |
* Les valeurs sont moyennes ± ET
Administration intraveineuse de NovoLog
Voir section Pharmacologie clinique / pharmacodynamique.
Haut
Comment fournis / stockage et manutention
NovoLog est disponible dans les formats d'emballage suivants: chaque présentation contenant 100 unités d'insuline asparte par ml (U-100).
| Flacons de 10 ml | NDC 0169-7501-11 |
| Cartouches PenFill de 3 ml * | NDC 0169-3303-12 |
| 3 ml de seringue préremplie NovoLog FlexPen | NDC 0169-6339-10 |
* Les cartouches NovoLog PenFill sont conçues pour être utilisées avec la cartouche Novo Nordisk PenFill 3 ml compatible dispositifs d'administration d'insuline (avec ou sans l'ajout d'un NovoPen 3 PenMate) avec NovoFine jetable aiguilles.
Stockage recommandé
NovoLog inutilisé doit être conservé au réfrigérateur entre 2 ° et 8 ° C (36 ° à 46 ° F). Ne pas stocker dans le congélateur ou directement à côté de l'élément de refroidissement du réfrigérateur. Ne congelez pas NovoLog et n'utilisez pas NovoLog s'il a été congelé. NovoLog ne doit pas être aspiré dans une seringue et conservé pour une utilisation ultérieure.
Flacons: Après la première utilisation, un flacon peut être conservé à des températures inférieures à 30 ° C (86 ° F) pendant 28 jours maximum, mais ne doit pas être exposé à une chaleur excessive ou à la lumière du soleil. Les flacons ouverts peuvent être réfrigérés.
Les flacons non perforés peuvent être utilisés jusqu'à la date de péremption imprimée sur l'étiquette s'ils sont conservés au réfrigérateur. Gardez les flacons inutilisés dans le carton afin qu'ils restent propres et protégés de la lumière.
Cartouches PenFill ou seringues préremplies NovoLog FlexPen:
Une fois qu'une cartouche ou une seringue préremplie NovoLog FlexPen est perforée, elle doit être conservée à des températures inférieures à 30 ° C (86 ° F) pendant 28 jours maximum, mais ne doit pas être exposée à une chaleur excessive ou à la lumière solaire. Les cartouches ou les seringues préremplies NovoLog FlexPen utilisées ne doivent PAS être conservées au réfrigérateur. Gardez toutes les cartouches PenFill® et les seringues jetables NovoLog FlexPen préremplies à l'abri de la chaleur directe et de la lumière du soleil. Les cartouches PenFill non perforées et les seringues préremplies NovoLog FlexPen peuvent être utilisées jusqu'à la date de péremption imprimée sur l'étiquette si elles sont conservées au réfrigérateur. Conservez les cartouches PenFill inutilisées et les seringues préremplies NovoLog FlexPen dans le carton afin qu'elles restent propres et protégées de la lumière.
Retirez toujours l'aiguille après chaque injection et conservez le dispositif d'administration de la cartouche PenFill de 3 ml ou la seringue préremplie NovoLog FlexPen sans aiguille attachée. Cela empêche la contamination et / ou l'infection, ou les fuites d'insuline, et garantira un dosage précis. Utilisez toujours une nouvelle aiguille pour chaque injection pour éviter toute contamination.
Pompe:
NovoLog dans le réservoir de la pompe doit être jeté après au moins toutes les 48 heures d'utilisation ou après une exposition à des températures dépassant 37 ° C (98,6 ° F).
Résumé des conditions de stockage:
Les conditions de stockage sont résumées dans le tableau suivant:
Tableau 9. Conditions de stockage du flacon, des cartouches PenFill et de la seringue préremplie NovoLog FlexPen
|
NovoLog présentation |
Température ambiante non utilisée (non ouverte) (inférieure à 30 ° C) | Non utilisé (non ouvert) Réfrigéré | Température ambiante en cours d'utilisation (ouverte) (inférieure à 30 ° C) |
| Flacon de 10 ml | 28 jours | Jusqu'à la date d'expiration | 28 jours (réfrigéré / température ambiante) |
| Cartouches PenFill de 3 ml | 28 jours | Jusqu'à la date d'expiration |
28 jours (Ne pas réfrigérer) |
| 3 ml de seringue préremplie NovoLog FlexPen | 28 jours | Jusqu'à la date d'expiration |
28 jours (Ne pas réfrigérer) |
Stockage de NovoLog dilué
NovoLog dilué avec du milieu de dilution d'insuline pour NovoLog à une concentration équivalente à U-10 ou équivalent à U-50 peut demeurer utilisé par le patient à des températures inférieures à 30 ° C (86 ° F) pendant 28 jours.
Stockage de NovoLog dans des liquides de perfusion
Les poches pour perfusion préparées comme indiqué sous Posologie et administration (2) sont stables à température ambiante pendant 24 heures. Une partie de l'insuline sera initialement adsorbée sur le matériau de la poche de perfusion.
dernière mise à jour 12/2008
NovoLog, insuline asparte, informations destinées aux patients (en anglais simple)
Informations détaillées sur les signes, les symptômes, les causes et les traitements du diabète
Les informations contenues dans cette monographie ne sont pas destinées à couvrir toutes les utilisations, directions, précautions, interactions médicamenteuses ou effets indésirables possibles. Ces informations sont généralisées et ne sont pas destinées à un avis médical spécifique. Si vous avez des questions sur les médicaments que vous prenez ou si vous souhaitez plus d'informations, consultez votre médecin, votre pharmacien ou votre infirmière.
retour à: Parcourir tous les médicaments pour le diabète


