Onglyza pour le traitement du diabète
Nom de la marque: Onglyza
Nom générique: saxagliptine
Forme posologique: comprimé, pelliculé
Contenu:
Indications et usage
Dosage et administration
Formes posologiques et forces
Contre-indications
Avertissements et precautions
Effets indésirables
Interactions médicamenteuses
Utilisation dans des populations spécifiques
Surdosage
La description
Pharmacologie
Toxicologie non clinique
Etudes cliniques
Comment fournie
Informations patient Onglyza (en anglais simple)
Indications et usage
Monothérapie et thérapie combinée
Onglyza est indiqué en complément du régime alimentaire et de l'exercice pour améliorer le contrôle glycémique chez les adultes atteints de diabète sucré de type 2. [Voir Etudes cliniques].
Limitations d'utilisation importantes
Onglyza ne doit pas être utilisé pour le traitement du diabète sucré de type 1 ou de l'acidocétose diabétique, car il ne serait pas efficace dans ces contextes.
Onglyza n'a pas été étudié en association avec l'insuline.
Haut
Dosage et administration
Dosage recommandé
La dose recommandée d'Onglyza est de 2,5 mg ou 5 mg une fois par jour, indépendamment des repas.
Patients atteints d'insuffisance rénale
Aucun ajustement posologique d'Onglyza n'est recommandé chez les patients présentant une insuffisance rénale légère (clairance de la créatinine [CrCl]> 50 ml / min).
La dose d'Onglyza est de 2,5 mg une fois par jour pour les patients présentant une insuffisance rénale modérée ou sévère, ou avec insuffisance rénale terminale (ESRD) nécessitant une hémodialyse (clairance de la créatinine [CrCl] â ‰ ¤50 mL / min). Onglyza doit être administré après hémodialyse. Onglyza n'a pas été étudié chez les patients subissant une dialyse péritonéale.
Étant donné que la dose d'Onglyza doit être limitée à 2,5 mg en fonction de la fonction rénale, une évaluation de la fonction rénale est recommandée avant l'initiation d'Onglyza et périodiquement par la suite. La fonction rénale peut être estimée à partir de la créatinine sérique en utilisant la formule Cockcroft-Gault ou la modification de la diète dans la formule de la maladie rénale. [Voir Pharmacologie clinique, Pharmacocinétique.]
Inhibiteurs puissants du CYP3A4 / 5
La dose d'Onglyza est de 2,5 mg une fois par jour en cas d'administration concomitante avec de puissants inhibiteurs du cytochrome P450 3A4 / 5 (CYP3A4 / 5) (par exemple, kétoconazole, atazanavir, clarithromycine, indinavir, itraconazole, néfazodone, nelfinavir, ritonavir, saquinavir et télithromycine). [Voir Interactions médicamenteuses, Inhibiteurs des enzymes CYP3A4 / 5 et Pharmacologie clinique, Pharmacocinétique.]
Haut
Formes posologiques et forces
- Les comprimés d'Onglyza (saxagliptine) à 5 mg sont des comprimés pelliculés roses, biconvexes, ronds, portant l'inscription «5» imprimée sur une face et «4215» imprimée sur l'envers, à l'encre bleue.
- Les comprimés d'Onglyza (saxagliptine) à 2,5 mg sont de couleur jaune pâle à jaune clair, biconvexes, ronds, pelliculés avec "2,5" imprimé sur une face et "4214" imprimé sur la face arrière, à l'encre bleue.
Haut
Contre-indications
Aucun.
Haut
Avertissements et precautions
Utilisation avec des médicaments connus pour provoquer une hypoglycémie
Les sécrétagogues de l'insuline, tels que les sulfonylurées, provoquent une hypoglycémie. Par conséquent, une dose plus faible du sécrétagogue d'insuline peut être nécessaire pour réduire le risque d'hypoglycémie lorsqu'il est utilisé en association avec Onglyza. [Voir Effets indésirables, Expérience des essais cliniques.]
Résultats macrovasculaires
Il n'y a eu aucune étude clinique établissant des preuves concluantes d'une réduction du risque macrovasculaire avec Onglyza ou tout autre médicament antidiabétique.
Haut
Effets indésirables
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d’effets indésirables observés dans les essais cliniques médicament ne peut être directement comparé aux taux des essais cliniques d'un autre médicament et peut ne pas refléter les taux entraine toi.
Monothérapie et thérapie combinée complémentaire
Dans deux essais contrôlés par placebo en monothérapie d'une durée de 24 semaines, les patients ont été traités par Onglyza 2,5 mg par jour, Onglyza 5 mg par jour et un placebo. Trois essais combinés complémentaires de 24 semaines contrôlés contre placebo ont également été menés: un avec la metformine, un avec une thiazolidinedione (pioglitazone ou rosiglitazone) et un avec le glyburide. Dans ces trois essais, les patients ont été randomisés pour recevoir un traitement complémentaire avec Onglyza 2,5 mg par jour, Onglyza 5 mg par jour ou un placebo. Un bras de traitement à la saxagliptine à 10 mg a été inclus dans l'un des essais en monothérapie et dans l'essai combiné avec la metformine.
Dans une analyse groupée prédéfinie des données sur 24 semaines (indépendamment du sauvetage glycémique) des deux essais en monothérapie, l’add-on à l’essai sur la metformine, l’add-on sur la thiazolidinedione (TZD), et le complément à l'essai au glyburide, l'incidence globale des événements indésirables chez les patients traités par Onglyza 2,5 mg et Onglyza 5 mg était similaire au placebo (72,0% et 72,2% contre 70,6%, respectivement). L'arrêt du traitement en raison d'événements indésirables s'est produit chez 2,2%, 3,3% et 1,8% des patients recevant Onglyza 2,5 mg, Onglyza 5 mg et un placebo, respectivement. Les événements indésirables les plus courants (rapportés chez au moins 2 patients traités par Onglyza 2,5 mg ou au moins 2 patients traités par Onglyza 5 mg) associés à l'arrêt prématuré du traitement comprenaient une lymphopénie (0,1% et 0,5% contre 0%, respectivement), une éruption cutanée (0,2% et 0,3% contre 0,3%), la créatinine sanguine a augmenté (0,3% et 0% contre 0%) et la créatine phosphokinase sanguine a augmenté (0,1% et 0,2% contre 0%). Les effets indésirables de cette analyse groupée ont été rapportés (quelle que soit l'évaluation de la causalité par l'investigateur) ‰ ¥ 5% des patients traités par Onglyza 5 mg et plus fréquemment que chez les patients traités par placebo sont Tableau 1.
Tableau 1: Effets indésirables (quelle que soit l'évaluation de la causalité par l'investigateur) dans les essais contrôlés par placebo * Déclaré chez 5% des patients traités par Onglyza 5 mg et plus fréquemment que chez les patients traités par Placebo
| Nombre (%) de patients | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Placebo N = 799 |
|
| * Les 5 essais contrôlés contre placebo comprennent deux essais en monothérapie et un essai de thérapie combinée complémentaire avec chacun des éléments suivants: metformine, thiazolidinedione ou glyburide. Le tableau montre les données sur 24 semaines indépendamment du sauvetage glycémique. | ||
| Infection des voies respiratoires supérieures | 68 (7.7) | 61 (7.6) |
| Infection urinaire | 60 (6.8) | 49 (6.1) |
| Mal de crâne | 57 (6.5) | 47 (5.9) |
Chez les patients traités par Onglyza 2,5 mg, les céphalées (6,5%) ont été le seul effet indésirable signalé à un taux de 5 ¥ 5% et plus fréquemment que chez les patients traités par placebo.
Dans cette analyse groupée, les effets indésirables rapportés chez 2% des patients traités par Onglyza 2,5 mg ou Onglyza 5 mg et 1% plus fréquemment par rapport au placebo comprenaient: sinusite (2,9% et 2,6% contre 1,6%, respectivement), douleurs abdominales (2,4% et 1,7% contre 0,5%), gastro-entérite (1,9% et 2,3% contre 0,9%) et vomissements (2,2% et 2,3% contre 1,3% ).
Dans le complément à l'essai TZD, l'incidence d'œdème périphérique était plus élevée pour Onglyza 5 mg par rapport au placebo (8,1% et 4,3%, respectivement). L'incidence d'œdème périphérique pour Onglyza 2,5 mg était de 3,1%. Aucun des effets indésirables rapportés de l'œdème périphérique n'a entraîné l'arrêt du médicament à l'étude. Les taux d'œdème périphérique pour Onglyza 2,5 mg et Onglyza 5 mg par rapport au placebo étaient de 3,6% et 2% contre 3% administrés en monothérapie, 2,1% et 2,1% contre 2,2% administrés en complément de la metformine, et 2,4% et 1,2% contre 2,2% administrés en complément de la metformine glyburide.
Le taux d'incidence des fractures était de 1,0 et 0,6 pour 100 patients-années, respectivement, pour Onglyza (analyse groupée de 2,5 mg, 5 mg et 10 mg) et le placebo. Le taux d'incidence des événements de fracture chez les patients qui ont reçu Onglyza n'a pas augmenté au fil du temps. La causalité n'a pas été établie et les études non cliniques n'ont pas mis en évidence d'effets indésirables de la saxagliptine sur les os.
Un événement de thrombocytopénie, compatible avec un diagnostic de purpura thrombocytopénique idiopathique, a été observé dans le programme clinique. La relation de cet événement avec Onglyza n'est pas connue.
Effets indésirables associés à Onglyza co-administré avec de la metformine chez des patients naïfs de traitement atteints de diabète de type 2
Le tableau 2 montre les effets indésirables signalés (quelle que soit l'évaluation de la causalité par l'investigateur) chez 5% des patients participant à un essai contrôlé actif de 24 semaines supplémentaires sur Onglyza et la metformine co-administrés dans un traitement naïf les patients.
Tableau 2: Traitement initial avec association d'Onglyza et de metformine chez des patients naïfs de traitement: effets indésirables signalés (quelle que soit l'évaluation de l'investigateur) de causalité) chez ‰ ¥ 5% des patients traités par thérapie combinée d'Onglyza 5 mg plus metformine (et plus fréquemment que chez les patients traités par metformine Seul)
| Nombre (%) de patients | ||
|---|---|---|
| Onglyza 5 mg + metformine * N = 320 |
Metformine * N = 328 |
|
| * La metformine a été initiée à une dose initiale de 500 mg par jour et titrée jusqu'à un maximum de 2000 mg par jour. | ||
| Mal de crâne | 24 (7.5) | 17 (5.2) |
| Rhinopharyngite | 22 (6.9) | 13 (4.0) |
Hypoglycémie
Les effets indésirables de l'hypoglycémie étaient basés sur tous les rapports d'hypoglycémie; une mesure concomitante du glucose n'était pas nécessaire. Dans l'étude complémentaire au glyburide, l'incidence globale des hypoglycémies signalées était plus élevée pour Onglyza 2,5 mg et Onglyza 5 mg (13,3% et 14,6%) par rapport au placebo (10,1%). L'incidence d'hypoglycémie confirmée dans cette étude, définie comme des symptômes d'hypoglycémie accompagnés d'un la valeur du glucose au bout de 50 ¤ ¤ 50 mg / dL était de 2,4% et 0,8% pour Onglyza 2,5 mg et Onglyza 5 mg et 0,7% pour placebo. L'incidence d'hypoglycémie rapportée pour Onglyza 2,5 mg et Onglyza 5 mg par rapport au placebo administré en monothérapie était de 4,0% et 5,6% par rapport à 4,1%, respectivement, 7,8% et 5,8% contre 5% administrés en complément de metformine, et 4,1% et 2,7% contre 3,8% administrés en complément de TZD. L'incidence d'hypoglycémie signalée était de 3,4% chez les patients naïfs de traitement ayant reçu Onglyza 5 mg plus metformine et de 4,0% chez les patients ayant reçu metformine seule.
Réactions d'hypersensibilité
Événements liés à l'hypersensibilité, tels que l'urticaire et l'œdème facial dans l'analyse groupée de 5 études jusqu'à la semaine 24 ont été rapportés chez 1,5%, 1,5% et 0,4% des patients ayant reçu Onglyza 2,5 mg, Onglyza 5 mg et un placebo, respectivement. Aucun de ces événements chez les patients ayant reçu Onglyza n'a nécessité une hospitalisation ou n'a été signalé comme mettant la vie en danger par les enquêteurs. Un patient traité à la saxagliptine dans cette analyse groupée a abandonné en raison d'une urticaire généralisée et d'un œdème facial.
Signes vitaux
Aucun changement cliniquement significatif des signes vitaux n'a été observé chez les patients traités par Onglyza.
Tests de laboratoire
Nombre absolu de lymphocytes
Une diminution moyenne liée à la dose du nombre absolu de lymphocytes a été observée avec Onglyza. À partir d'un nombre de lymphocytes absolu moyen de référence d'environ 2200 cellules / microL, une diminution moyenne d'environ 100 et 120 cellules / microL avec Onglyza 5 mg et 10 mg, respectivement, par rapport au placebo ont été observés à 24 semaines dans une analyse groupée de cinq essais cliniques contrôlés par placebo études. Des effets similaires ont été observés lorsque Onglyza 5 mg a été administré en association initiale avec la metformine par rapport à la metformine seule. Aucune différence n'a été observée pour Onglyza 2,5 mg par rapport au placebo. La proportion de patients dont le nombre de lymphocytes était rapporté - 750 ¤ cellules / microL était de 0,5%, 1,5%, 1,4% et 0,4% dans les groupes saxagliptine 2,5 mg, 5 mg, 10 mg et placebo, respectivement. Chez la plupart des patients, aucune récidive n'a été observée lors d'expositions répétées à Onglyza, bien que certains patients aient présenté des diminutions récurrentes lors de la reprise qui ont conduit à l'arrêt d'Onglyza. Les diminutions du nombre de lymphocytes n'étaient pas associées à des effets indésirables cliniquement pertinents.
La signification clinique de cette diminution du nombre de lymphocytes par rapport au placebo n'est pas connue. Lorsqu'il est cliniquement indiqué, par exemple dans des situations d'infection inhabituelle ou prolongée, le nombre de lymphocytes doit être mesuré. L'effet d'Onglyza sur le nombre de lymphocytes chez les patients présentant des anomalies lymphocytaires (par exemple, le virus de l'immunodéficience humaine) est inconnu.
Plaquettes
Onglyza n'a pas démontré d'effet cliniquement significatif ou cohérent sur la numération plaquettaire dans les six essais cliniques contrôlés en double aveugle sur l'innocuité et l'efficacité.
Haut
Interactions médicamenteuses
Inducteurs des enzymes CYP3A4 / 5
La rifampicine a considérablement réduit l'exposition à la saxagliptine sans modification de la zone sous la courbe de concentration en temps (ASC) de son métabolite actif, la 5-hydroxy saxagliptine. L'inhibition de l'activité plasmatique de la dipeptidyl peptidase-4 (DPP4) sur un intervalle de dose de 24 heures n'a pas été affectée par la rifampicine. Par conséquent, l'ajustement de la posologie d'Onglyza n'est pas recommandé. [Voir Pharmacologie clinique, Pharmacocinétique.]
Inhibiteurs des enzymes CYP3A4 / 5
Inhibiteurs modérés du CYP3A4 / 5
Le diltiazem a augmenté l'exposition à la saxagliptine. Des augmentations similaires des concentrations plasmatiques de saxagliptine sont attendues en présence d'autres CYP3A4 / 5 modérés. des inhibiteurs (par exemple, l'amprénavir, l'aprépitant, l'érythromycine, le fluconazole, le fosamprénavir, le jus de pamplemousse et le vérapamil); cependant, il n'est pas recommandé d'ajuster la posologie d'Onglyza. [Voir Pharmacologie clinique, Pharmacocinétique.]
Inhibiteurs puissants du CYP3A4 / 5
Le kétoconazole a considérablement augmenté l'exposition à la saxagliptine. Des augmentations significatives similaires des concentrations plasmatiques de saxagliptine sont attendues avec d'autres inhibiteurs puissants du CYP3A4 / 5 (par exemple, atazanavir, clarithromycine, indinavir, itraconazole, néfazodone, nelfinavir, ritonavir, saquinavir et télithromycine). La dose d'Onglyza doit être limitée à 2,5 mg en cas d'administration concomitante avec un puissant inhibiteur du CYP3A4 / 5. [Voir Dosage et administration, Inhibiteurs puissants du CYP3A4 / 5 et Pharmacologie clinique, Pharmacocinétique.]
Haut
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études de reproduction animale ne sont pas toujours prédictives de la réponse humaine, Onglyza, comme les autres médicaments antidiabétiques, ne doit être utilisé pendant la grossesse que si cela est clairement nécessaire.
La saxagliptine n'a été tératogène à aucune dose testée lorsqu'elle a été administrée à des rates et à des lapines gravides pendant les périodes d'organogenèse. Une ossification incomplète du bassin, une forme de retard de développement, s'est produite chez le rat à une dose de 240 mg / kg, soit environ 1503 et 66 fois l'exposition humaine à la saxagliptine et au métabolite actif, respectivement, à la dose humaine maximale recommandée (MRHD) de 5 mg. Une toxicité maternelle et une réduction du poids corporel fœtal ont été observées à 7986 et 328 fois l'exposition humaine au MRHD pour la saxagliptine et le métabolite actif, respectivement. Des variations mineures du squelette chez le lapin se sont produites à une dose toxique pour la mère de 200 mg / kg, soit environ 1432 et 992 fois la MRHD. Administrée à des rats en association avec la metformine, la saxagliptine n'était ni tératogène ni embryolétale à des expositions 21 fois supérieures à la saxagliptine MRHD. L'administration combinée de metformine avec une dose plus élevée de saxagliptine (109 fois la saxagliptine MRHD) a été associée à craniorachischisis (une anomalie rare du tube neural caractérisée par une fermeture incomplète du crâne et de la colonne vertébrale) chez deux fœtus barrage unique. Les expositions à la metformine dans chaque combinaison étaient 4 fois l'exposition humaine de 2000 mg par jour.
La saxagliptine administrée à des rats femelles du 6e jour de gestation au 20e jour de lactation a entraîné une diminution du poids corporel chez les mâles et les femelles. progéniture femelle uniquement à des doses toxiques pour la mère (expositions à 1629 ¥ et 53 fois la saxagliptine et son métabolite actif au MRHD). Aucune toxicité fonctionnelle ou comportementale n'a été observée chez la progéniture de rats auxquels on a administré de la saxagliptine à quelque dose que ce soit.
La saxagliptine traverse le placenta dans le fœtus après administration chez des rates gravides.
Mères allaitantes
La saxagliptine est sécrétée dans le lait des rates allaitantes à un rapport d'environ 1: 1 avec les concentrations plasmatiques du médicament. On ne sait pas si la saxagliptine est sécrétée dans le lait maternel. Étant donné que de nombreux médicaments sont sécrétés dans le lait maternel, la prudence s'impose lorsque Onglyza est administré à une femme qui allaite.
Utilisation pédiatrique
La sécurité et l'efficacité d'Onglyza chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Dans les six essais cliniques à double insu et contrôlés sur l'innocuité et l'efficacité d'Onglyza, 634 (15,3%) des 4148 patients randomisés étaient âgés de 65 ans et plus, et 59 (1,4%) patients avaient 75 ans et plus. Aucune différence globale de sécurité ou d'efficacité n'a été observée entre les patients de 65 ans et plus et les patients plus jeunes. Bien que cette expérience clinique n'ait pas identifié de différences de réponses entre les patients âgés et les patients plus jeunes, une plus grande sensibilité de certaines personnes âgées ne peut être exclue.
La saxagliptine et son métabolite actif sont éliminés en partie par le rein. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, une attention particulière doit être portée à la sélection de la dose chez les personnes âgées en fonction de la fonction rénale. [Voir Dosage et administration, Patients atteints d'insuffisance rénale et Pharmacologie clinique, Pharmacocinétique.]
Haut
Surdosage
Dans un essai clinique contrôlé, une fois par jour, Onglyza administré par voie orale chez des sujets sains à des doses allant jusqu'à 400 mg par jour pendant 2 semaines (80 fois la MRHD) n'a eu aucun effet indésirable clinique lié à la dose et aucun effet cliniquement significatif sur l'intervalle QTc ou le cœur taux.
En cas de surdosage, un traitement de soutien approprié doit être instauré en fonction de l'état clinique du patient. La saxagliptine et son métabolite actif sont éliminés par hémodialyse (23% de la dose sur 4 heures).
Haut
La description
La saxagliptine est un inhibiteur oralement actif de l'enzyme DPP4.
La saxagliptine monohydratée est décrite chimiquement comme (1S, 3S, 5S) -2 - [(2S) -2-Amino-2- (3-hydroxytricyclo [3.3.1.13,7] déc-1-yl) acétyl] -2-azabicyclo [3.1.0] hexane-3-carbonitrile, monohydraté ou (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino - 2 - (3 - hydroxyadamantan - 1 - yl) acétyl] - 2 - azabicyclo [3.1.0] hexane - 3 - carbonitrile hydrater. La formule empirique est C18H25N3O2-H2O et le poids moléculaire est de 333,43. La formule structurelle est:
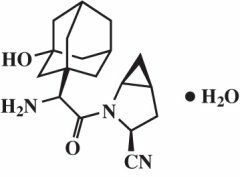
La saxagliptine monohydratée est une poudre cristalline non hygroscopique blanche à jaune clair ou brun clair. Il est peu soluble dans l'eau à 24 ° C ± 3 ° C, légèrement soluble dans l'acétate d'éthyle et soluble dans le méthanol, l'éthanol, l'alcool isopropylique, l'acétonitrile, l'acétone et le polyéthylène glycol 400 (PEG 400).
Chaque comprimé pelliculé d'Onglyza à usage oral contient soit 2,79 mg de chlorhydrate de saxagliptine (anhydre) équivalent à 2,5 mg de saxagliptine ou 5,58 mg de saxagliptine chlorhydrate (anhydre) équivalent à 5 mg de saxagliptine et les ingrédients inactifs suivants: lactose monohydraté, cellulose microcristalline, croscarmellose sodique et stéarate de magnésium. De plus, le film pelliculé contient les ingrédients inactifs suivants: alcool polyvinylique, polyéthylène glycol, dioxyde de titane, talc et oxydes de fer.
Haut
Pharmacologie clinique
Mécanisme d'action
Augmentation des concentrations des hormones incrétines telles que le glucagon-like peptide-1 (GLP-1) et le glucose-dépendant le polypeptide insulinotrope (GIP) est libéré dans la circulation sanguine de l'intestin grêle en réponse à repas. Ces hormones provoquent la libération d'insuline des cellules bêta pancréatiques d'une manière dépendante du glucose mais sont inactivées par l'enzyme dipeptidyl peptidase-4 (DPP4) en quelques minutes. Le GLP-1 réduit également la sécrétion de glucagon des cellules alpha pancréatiques, réduisant la production hépatique de glucose. Chez les patients atteints de diabète de type 2, les concentrations de GLP-1 sont réduites mais la réponse de l'insuline au GLP-1 est préservée. La saxagliptine est un inhibiteur compétitif de la DPP4 qui ralentit l'inactivation des hormones incrétines, augmentant ainsi leur circulation sanguine les concentrations de glucose à jeun et postprandiales de façon dépendante du glucose chez les patients atteints de diabète de type 2 sucré.
Pharmacodynamique
Chez les patients atteints de diabète sucré de type 2, l'administration d'Onglyza inhibe l'activité enzymatique DPP4 pendant une période de 24 heures. Après une charge de glucose par voie orale ou un repas, cette inhibition de la DPP4 a entraîné une augmentation de 2 à 3 fois des niveaux circulants de GLP-1 et GIP, diminution des concentrations de glucagon et augmentation de la sécrétion d'insuline glucose-dépendante des cellules bêta pancréatiques. L'augmentation de l'insuline et la diminution du glucagon ont été associées à des concentrations de glucose à jeun plus faibles et à une excursion de glucose réduite après une charge de glucose par voie orale ou un repas.
Électrophysiologie cardiaque
Dans une étude de comparaison active randomisée, en double aveugle, contrôlée contre placebo, à 4 voies, utilisant la moxifloxacine chez 40 sujets sains, Onglyza n'a pas été associé à une prolongation cliniquement significative de l'intervalle QTc ou de la fréquence cardiaque à des doses quotidiennes allant jusqu'à 40 mg (8 fois la MRHD).
Pharmacocinétique
La pharmacocinétique de la saxagliptine et de son métabolite actif, la 5-hydroxy saxagliptine, était similaire chez les sujets sains et chez les patients atteints de diabète sucré de type 2. Le Cmax et les valeurs d'AUC de la saxagliptine et de son métabolite actif ont augmenté proportionnellement dans la plage de doses de 2,5 à 400 mg. Après une dose orale unique de 5 mg de saxagliptine à des sujets sains, les valeurs plasmatiques moyennes de l'ASC pour la saxagliptine et son métabolite actif étaient respectivement de 78 ng-h / mL et 214 ng-h / mL. Le plasma C correspondantmax les valeurs étaient respectivement de 24 ng / ml et 47 ng / ml. La variabilité moyenne (% CV) pour AUC et Cmax la saxagliptine et son métabolite actif étaient inférieurs à 25%.
Aucune accumulation appréciable de saxagliptine ou de son métabolite actif n'a été observée avec l'administration répétée d'une fois par jour à n'importe quel niveau de dose. Aucune dépendance en fonction de la dose et du temps n'a été observée dans la clairance de la saxagliptine et de son métabolite actif pendant 14 jours d'administration quotidienne de saxagliptine à des doses allant de 2,5 à 400 mg.
Absorption
Le temps médian jusqu'à la concentration maximale (Tmax) après la dose de 5 mg une fois par jour était de 2 heures pour la saxagliptine et de 4 heures pour son métabolite actif. L'administration avec un repas riche en graisses a entraîné une augmentation de la Tmax de saxagliptine d'environ 20 minutes par rapport aux conditions de jeûne. Il y avait une augmentation de 27% de l'ASC de la saxagliptine lorsqu'elle était administrée avec un repas par rapport aux conditions de jeûne. Onglyza peut être administré avec ou sans nourriture.
Distribution
La liaison aux protéines in vitro de la saxagliptine et de son métabolite actif dans le sérum humain est négligeable. Par conséquent, les changements dans les taux de protéines sanguines dans divers états pathologiques (par exemple, insuffisance rénale ou hépatique) ne devraient pas modifier la disposition de la saxagliptine.
Métabolisme
Le métabolisme de la saxagliptine est principalement médié par le cytochrome P450 3A4 / 5 (CYP3A4 / 5). Le principal métabolite de la saxagliptine est également un inhibiteur de la DPP4, qui est deux fois moins puissant que la saxagliptine. Par conséquent, de puissants inhibiteurs et inducteurs du CYP3A4 / 5 modifieront la pharmacocinétique de la saxagliptine et de son métabolite actif. [Voir Interactions médicamenteuses.]
Excrétion
La saxagliptine est éliminée par les voies rénales et hépatiques. Après une dose unique de 50 mg de 14La c-saxagliptine, 24%, 36% et 75% de la dose a été excrétée dans l'urine sous forme de saxagliptine, son métabolite actif et la radioactivité totale, respectivement. La clairance rénale moyenne de la saxagliptine (~ 230 ml / min) était supérieure au débit de filtration glomérulaire estimé moyen (~ 120 ml / min), suggérant une certaine excrétion rénale active. Un total de 22% de la radioactivité administrée a été récupérée dans les fèces représentant la fraction de la dose de saxagliptine excrétée dans la bile et / ou le médicament non absorbé par le tractus gastro-intestinal. Après une dose orale unique d'Onglyza 5 mg à des sujets sains, la demi-vie plasmatique terminale moyenne (t1/2) pour la saxagliptine et son métabolite actif était respectivement de 2,5 et 3,1 heures.
Populations spécifiques
Insuffisance rénale
Une étude en ouvert à dose unique a été menée pour évaluer la pharmacocinétique de la saxagliptine (dose de 10 mg) Sujets présentant divers degrés d'insuffisance rénale chronique (N = 8 par groupe) par rapport aux sujets ayant une insuffisance rénale normale une fonction. L'étude a inclus des patients atteints d'insuffisance rénale classés sur la base de la clairance de la créatinine comme légers (> 50 à 80 ¤ mL / min), modéré (30 à ¤50 mL / min) et sévère (<30 mL / min), ainsi que les patients atteints d'insuffisance rénale terminale au hémodialyse. La clairance de la créatinine a été estimée à partir de la créatinine sérique sur la base de la formule de Cockcroft-Gault:
CrCl = [140 - âge (années)] × poids (kg) {× 0,85 pour les patientes}
[72 × créatinine sérique (mg / dL)]
Le degré d'insuffisance rénale n'a pas affecté la Cmax de la saxagliptine ou de son métabolite actif. Chez les sujets présentant une insuffisance rénale légère, les valeurs d'AUC de la saxagliptine et de son métabolite actif étaient respectivement de 20% et 70% supérieures aux valeurs d'AUC chez les sujets dont la fonction rénale était normale. Étant donné que des augmentations de cette ampleur ne sont pas considérées comme cliniquement pertinentes, il n'est pas recommandé d'ajuster la posologie chez les patients présentant une insuffisance rénale légère. Chez les sujets présentant une insuffisance rénale modérée ou sévère, les valeurs AUC de la saxagliptine et de ses métabolite étaient jusqu'à 2,1 et 4,5 fois plus élevés, respectivement, que les valeurs de l'ASC chez les sujets ayant une une fonction. Pour obtenir des expositions plasmatiques à la saxagliptine et à son métabolite actif similaires à celles des patients dont la fonction rénale est normale, la dose recommandée est de 2,5 mg une fois par jour chez les patients atteints d'insuffisance rénale modérée à sévère, ainsi que chez les patients atteints d'insuffisance rénale terminale nécessitant hémodialyse. La saxagliptine est éliminée par hémodialyse.
Insuffisance hépatique
Chez les sujets atteints d'insuffisance hépatique (classes Child-Pugh A, B et C), la moyenne Cmax et l'ASC de la saxagliptine étaient respectivement jusqu'à 8% et 77% supérieures à celles des témoins appariés sains après l'administration d'une dose unique de 10 mg de saxagliptine. Le C correspondantmax et l'ASC du métabolite actif étaient respectivement jusqu'à 59% et 33% inférieurs à ceux des témoins appariés sains. Ces différences ne sont pas considérées comme cliniquement significatives. Aucun ajustement posologique n'est recommandé pour les patients atteints d'insuffisance hépatique.
Indice de masse corporelle
Aucun ajustement posologique n'est recommandé en fonction de l'indice de masse corporelle (IMC) qui n'a pas été identifié comme covariable sur la clairance apparente de la saxagliptine ou de son métabolite actif dans la population pharmacocinétique une analyse.
Le sexe
Aucun ajustement posologique n'est recommandé en fonction du sexe. Aucune différence n'a été observée dans la pharmacocinétique de la saxagliptine entre les hommes et les femmes. Comparativement aux hommes, les femmes avaient des valeurs d'exposition d'environ 25% plus élevées pour le métabolite actif que les hommes, mais il est peu probable que cette différence soit d'importance clinique. Le sexe n'a pas été identifié comme covariable significative sur la clairance apparente de la saxagliptine et de son métabolite actif dans l'analyse pharmacocinétique de population.
Gériatrique
Aucun ajustement posologique n'est recommandé en fonction de l'âge uniquement. Les sujets âgés (65-80 ans) avaient une moyenne géométrique C 23% et 59% plus élevéemax et les valeurs géométriques moyennes de l'ASC, respectivement, pour la saxagliptine par rapport aux sujets jeunes (18-40 ans). Les différences de pharmacocinétique des métabolites actifs entre les sujets âgés et les jeunes reflètent généralement les différences observées dans la pharmacocinétique de la saxagliptine. La différence entre la pharmacocinétique de la saxagliptine et du métabolite actif chez les jeunes et les personnes âgées chez les sujets est probablement due à de multiples facteurs, notamment la diminution de la fonction rénale et de la capacité l'âge augmente. L'âge n'a pas été identifié comme une covariable significative sur la clairance apparente de la saxagliptine et de son métabolite actif dans l'analyse pharmacocinétique de population
Pédiatrique
Aucune étude caractérisant la pharmacocinétique de la saxagliptine chez les patients pédiatriques n'a été réalisée.
Race et origine ethnique
Aucun ajustement posologique n'est recommandé en fonction de la race. L'analyse pharmacocinétique de population a comparé la pharmacocinétique de la saxagliptine et de ses métabolite chez 309 sujets caucasiens et 105 sujets non caucasiens (consistant en six races groupes). Aucune différence significative dans la pharmacocinétique de la saxagliptine et de son métabolite actif n'a été détectée entre ces deux populations.
Interactions médicament-médicament
Évaluation in vitro des interactions médicamenteuses
Le métabolisme de la saxagliptine est principalement médié par le CYP3A4 / 5.
Dans les études in vitro, la saxagliptine et son métabolite actif n'ont pas inhibé les CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A4, ni induit les CYP1A2, 2B6, 2C9 ou 3A4. Par conséquent, la saxagliptine ne devrait pas modifier la clairance métabolique des médicaments co-administrés qui sont métabolisés par ces enzymes. La saxagliptine est un substrat de la glycoprotéine P (P-gp) mais n'est pas un inhibiteur ni un inducteur significatif de la P-gp.
La liaison aux protéines in vitro de la saxagliptine et de son métabolite actif dans le sérum humain est négligeable. Ainsi, la liaison aux protéines n'aurait pas d'influence significative sur la pharmacocinétique de la saxagliptine ou d'autres médicaments.
Évaluation in vivo des interactions médicamenteuses
Effets de la saxagliptine sur d'autres médicaments
Dans les études menées chez des sujets sains, comme décrit ci-dessous, la saxagliptine n'a pas modifié de manière significative pharmacocinétique de la metformine, du glyburide, de la pioglitazone, de la digoxine, de la simvastatine, du diltiazem ou du kétoconazole.
Metformine: L'administration concomitante d'une dose unique de saxagliptine (100 mg) et de metformine (1000 mg), un substrat de l'hOCT-2, n'a pas modifié la pharmacocinétique de la metformine chez des sujets sains. Par conséquent, Onglyza n'est pas un inhibiteur du transport induit par l'hOCT-2.
Glyburide: L'administration concomitante d'une dose unique de saxagliptine (10 mg) et de glyburide (5 mg), un substrat du CYP2C9, a augmenté le plasma Cmax de glyburide de 16%; cependant, l'ASC du glyburide était inchangée. Par conséquent, Onglyza n'inhibe pas de manière significative le métabolisme induit par le CYP2C9.
Pioglitazone: l'administration concomitante de plusieurs doses une fois par jour de saxagliptine (10 mg) et de pioglitazone (45 mg), un substrat du CYP2C8, a augmenté le C plasmatiquemax de pioglitazone de 14%; cependant, l'ASC de la pioglitazone est restée inchangée.
Digoxine: l'administration concomitante de plusieurs doses une fois par jour de saxagliptine (10 mg) et de digoxine (0,25 mg), un substrat de la P-gp, n'a pas modifié la pharmacocinétique de la digoxine. Par conséquent, Onglyza n'est pas un inhibiteur ou un inducteur du transport médié par la P-gp.
Simvastatine: l'administration concomitante de plusieurs doses une fois par jour de saxagliptine (10 mg) et de simvastatine (40 mg), un substrat du CYP3A4 / 5, n'a pas modifié la pharmacocinétique de la simvastatine. Par conséquent, Onglyza n'est ni un inhibiteur ni un inducteur du métabolisme médié par le CYP3A4 / 5.
Diltiazem: L'administration concomitante de plusieurs doses une fois par jour de saxagliptine (10 mg) et de diltiazem (formulation à action prolongée de 360 mg à l'état d'équilibre), un inhibiteur modéré du CYP3A4 / 5, a augmenté le C plasmatiquemax de diltiazem de 16%; cependant, l'ASC du diltiazem est restée inchangée.
Kétoconazole: co-administration d'une dose unique de saxagliptine (100 mg) et de doses multiples de kétoconazole (200 mg toutes les 12 heures à à l'état d'équilibre), un inhibiteur puissant du CYP3A4 / 5 et de la P-gp, a diminué la Cmax plasmatique et l'ASC du kétoconazole de 16% et 13%, respectivement.
Effets d'autres médicaments sur la saxagliptine
Metformine: L'administration concomitante d'une dose unique de saxagliptine (100 mg) et de metformine (1000 mg), un substrat de l'hOCT-2, a diminué le Cmax de saxagliptine de 21%; cependant, l'AUC est restée inchangée.
Glyburide: L'administration concomitante d'une dose unique de saxagliptine (10 mg) et de glyburide (5 mg), un substrat du CYP2C9, a augmenté le Cmax de saxagliptine de 8%; cependant, l'ASC de la saxagliptine est restée inchangée.
Pioglitazone: co-administration de plusieurs doses une fois par jour de saxagliptine (10 mg) et de pioglitazone (45 mg), un substrat du CYP2C8 (majeur) et du CYP3A4 (mineur), n'a pas modifié la pharmacocinétique de saxagliptine.
Digoxine: l'administration concomitante de plusieurs doses une fois par jour de saxagliptine (10 mg) et de digoxine (0,25 mg), un substrat de la P-gp, n'a pas modifié la pharmacocinétique de la saxagliptine.
Simvastatine: L'administration concomitante de plusieurs doses une fois par jour de saxagliptine (10 mg) et de simvastatine (40 mg), un substrat du CYP3A4 / 5, a augmenté la Cmax de saxagliptine de 21%; cependant, l'ASC de la saxagliptine est restée inchangée.
Diltiazem: L'administration concomitante d'une dose unique de saxagliptine (10 mg) et de diltiazem (formulation à action prolongée de 360 mg à l'état d'équilibre), un inhibiteur modéré du CYP3A4 / 5, a augmenté la Cmax de saxagliptine de 63% et l'ASC de 2,1 fois. Ceci était associé à une diminution correspondante du Cmax et l'ASC du métabolite actif de 44% et 36%, respectivement.
Kétoconazole: l'administration concomitante d'une dose unique de saxagliptine (100 mg) et de kétoconazole (200 mg toutes les 12 heures à l'état d'équilibre), un puissant inhibiteur du CYP3A4 / 5 et de la P-gp, a augmenté la Cmax pour la saxagliptine de 62% et l'ASC de 2,5 fois. Ceci était associé à une diminution correspondante du Cmax et l'ASC du métabolite actif de 95% et 91%, respectivement.
Dans une autre étude, la co-administration d'une dose unique de saxagliptine (20 mg) et de kétoconazole (200 mg toutes les 12 heures à l'état d'équilibre), a augmenté le Cmax et l'ASC de la saxagliptine de 2,4 fois et 3,7 fois, respectivement. Ceci était associé à une diminution correspondante du Cmax et l'ASC du métabolite actif de 96% et 90%, respectivement.
Rifampicine: L'administration concomitante d'une dose unique de saxagliptine (5 mg) et de rifampicine (600 mg QD à l'état d'équilibre) a diminué le Cmax et l'ASC de la saxagliptine de 53% et 76%, respectivement, avec une augmentation correspondante de la Cmax (39%) mais aucun changement significatif dans l'ASC plasmatique du métabolite actif.
Oméprazole: co-administration de plusieurs doses une fois par jour de saxagliptine (10 mg) et d'oméprazole (40 mg), un CYP2C19 (majeur) et le substrat du CYP3A4, un inhibiteur du CYP2C19 et un inducteur du MRP-3, n'ont pas modifié la pharmacocinétique de saxagliptine.
Hydroxyde d'aluminium + hydroxyde de magnésium + siméthicone: co-administration d'une dose unique de saxagliptine (10 mg) et d'un liquide contenant de l'hydroxyde d'aluminium (2400 mg), de l'hydroxyde de magnésium (2400 mg) et de la siméthicone (240 mg) a diminué le Cmax de saxagliptine de 26%; cependant, l'ASC de la saxagliptine est restée inchangée.
Famotidine: l'administration d'une dose unique de saxagliptine (10 mg) 3 heures après une dose unique de famotidine (40 mg), un inhibiteur de hOCT-1, hOCT-2 et hOCT-3, a augmenté la Cmax de saxagliptine de 14%; cependant, l'ASC de la saxagliptine est restée inchangée.
Haut
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
La saxagliptine n'a induit aucune tumeur chez la souris (50, 250 et 600 mg / kg) ni chez le rat (25, 75, 150 et 300 mg / kg) aux doses les plus élevées évaluées. Les doses les plus élevées évaluées chez la souris étaient équivalentes à environ 870 (mâles) et 1165 (femelles) fois l'exposition humaine au MRHD de 5 mg / jour. Chez le rat, les expositions étaient environ 355 (mâles) et 2217 (femelles) fois la MRHD.
La saxagliptine n'a pas été mutagène ni clastogène avec ou sans activation métabolique dans un test bactérien in vitro d'Ames, un test cytogénétique in vitro chez l'homme primaire. lymphocytes, un essai oral in vivo du micronoyau chez le rat, une étude de réparation de l'ADN oral in vivo chez le rat et une étude de cytogénétique orale in vivo / in vitro dans le sang périphérique de rat lymphocytes. Le métabolite actif n'était pas mutagène lors d'un essai bactérien Ames in vitro.
Dans une étude de fertilité chez le rat, les mâles ont été traités avec des doses de gavage oral pendant 2 semaines avant l'accouplement, pendant l'accouplement et jusqu'à terminaison (environ 4 semaines au total) et les femelles ont été traitées avec des doses de gavage oral pendant 2 semaines avant l'accouplement pendant la gestation jour 7. Aucun effet indésirable sur la fertilité n'a été observé à des expositions d'environ 603 (hommes) et 776 (femmes) fois la MRHD. Des doses plus élevées qui ont provoqué une toxicité maternelle ont également augmenté les résorptions fœtales (environ 2069 et 6138 fois la MRHD). Des effets supplémentaires sur le cycle œstral, la fertilité, l'ovulation et l'implantation ont été observés à environ 6138 fois la MRHD.
Toxicologie animale
La saxagliptine a provoqué des changements cutanés indésirables aux extrémités des singes cynomolgus (croûtes et / ou ulcération de la queue, des doigts, du scrotum et / ou du nez). Les lésions cutanées étaient réversibles à 20 fois le MRHD, mais dans certains cas, elles étaient irréversibles et nécrosantes à des expositions plus élevées. Aucun changement cutané indésirable n'a été observé à des expositions similaires à (1 à 3 fois) la MRHD de 5 mg. Aucun corrélat clinique avec les lésions cutanées chez le singe n'a été observé dans les essais cliniques humains sur la saxagliptine.
Haut
Etudes cliniques
Onglyza a été étudié en monothérapie et en association avec la metformine, le glyburide et la thiazolidinedione (pioglitazone et rosiglitazone). Onglyza n'a pas été étudié en association avec l'insuline.
Au total, 4148 patients atteints de diabète sucré de type 2 ont été randomisés dans six essais cliniques contrôlés en double aveugle menés pour évaluer l'innocuité et l'efficacité glycémique d'Onglyza. Au total, 3021 patients dans ces essais ont été traités par Onglyza. Dans ces essais, l'âge moyen était de 54 ans et 71% des patients étaient de race blanche, 16% étaient asiatiques, 4% étaient noirs et 9% appartenaient à d'autres groupes raciaux. Un autre 423 patients, dont 315 qui ont reçu Onglyza, ont participé à une étude contrôlée par placebo, allant de 6 à 12 semaines.
Dans ces six essais en double aveugle, Onglyza a été évalué à des doses de 2,5 mg et 5 mg une fois par jour. Trois de ces essais ont également évalué une dose de saxagliptine de 10 mg par jour. La dose quotidienne de 10 mg de saxagliptine n'a pas fourni une plus grande efficacité que la dose quotidienne de 5 mg. Le traitement par Onglyza à toutes les doses a produit des améliorations cliniquement pertinentes et statistiquement significatives de l'hémoglobine A1c (A1C), la glycémie à jeun (FPG) et la glycémie postprandiale de 2 heures (PPG) après un test standard de tolérance au glucose par voie orale (OGTT), par rapport à contrôle. Des réductions de l'A1C ont été observées dans les sous-groupes, y compris le sexe, l'âge, la race et l'IMC de base.
Onglyza n'a pas été associé à des changements significatifs par rapport au départ du poids corporel ou des lipides sériques à jeun par rapport au placebo.
Monothérapie
Un total de 766 patients atteints de diabète de type 2 mal contrôlés sur le régime alimentaire et l'exercice (A1C â ‰ ¥ 7% à â ‰ ¤ 10%) a participé à deux essais contrôlés par placebo en double aveugle de 24 semaines évaluant l'efficacité et l'innocuité d'Onglyza monothérapie.
Dans le premier essai, après un régime à simple insu de 2 semaines, de l'exercice et une période d'introduction du placebo, 401 patients ont été randomisés à 2,5 mg, 5 mg ou 10 mg d'Onglyza ou d'un placebo. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours de l'étude ont été traités par une thérapie de sauvetage à la metformine, ajoutée à un placebo ou à Onglyza. L'efficacité a été évaluée à la dernière mesure avant le traitement de sauvetage pour les patients nécessitant un sauvetage. La titration de la dose d'Onglyza n'était pas autorisée.
Le traitement par Onglyza 2,5 mg et 5 mg par jour a fourni des améliorations significatives de A1C, FPG et PPG par rapport au placebo (tableau 3). Le pourcentage de patients qui ont arrêté pour manque de contrôle glycémique ou qui ont été secourus pour avoir rencontré une réunion prédéfinie le critère glycémique était de 16% dans le groupe de traitement Onglyza 2,5 mg, 20% dans le groupe de traitement Onglyza 5 mg et 26% dans le groupe groupe placebo.
Tableau 3: Paramètres glycémiques à la semaine 24 dans une étude contrôlée par placebo sur Onglyza en monothérapie chez des patients atteints de diabète de type 2 *
| Paramètre d'efficacité | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Placebo N = 95 |
|---|---|---|---|
| * Population en intention de traiter utilisant la dernière observation de l'étude ou la dernière observation avant le traitement de sauvetage à la metformine pour les patients nécessitant un sauvetage. | |||
| †Moyenne des moindres carrés ajustée pour la valeur de base. | |||
| c Valeur p <0,0001 par rapport au placebo | |||
| § valeur p <0,05 par rapport au placebo | |||
| ¶ La signification n'a pas été testée pour le PPG de 2 heures pour la dose de 2,5 mg d'Onglyza. | |||
| Hémoglobine a1c (%) | N = 100 | N = 103 | N = 92 |
| Référence (moyenne) | 7.9 | 8.0 | 7.9 |
| Changement par rapport à la référence (moyenne ajustée†) | −0.4 | −0.5 | +0.2 |
| Différence par rapport au placebo (moyenne ajustée†) | −0.6c | −0.6c | |
| Intervalle de confiance à 95% | (−0.9, −0.3) | (−0.9, −0.4) | |
| Pourcentage de patients atteignant A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Glucose plasmatique à jeun (mg / dL) | N = 101 | N = 105 | N = 92 |
| Référence (moyenne) | 178 | 171 | 172 |
| Changement par rapport à la référence (moyenne ajustée†) | −15 | −9 | +6 |
| Différence par rapport au placebo (moyenne ajustée†) | −21 § | −15 § | |
| Intervalle de confiance à 95% | (−31, −10) | (−25, −4) | |
| Glucose postprandial de 2 heures (mg / dL) | N = 78 | N = 84 | N = 71 |
| Référence (moyenne) | 279 | 278 | 283 |
| Changement par rapport à la référence (moyenne ajustée†) | −45 | −43 | −6 |
| Différence par rapport au placebo (moyenne ajustée†) | −39 ¶ | −37 § | |
| Intervalle de confiance à 95% | (−61, −16) | (−59, −15) |
Un deuxième essai de monothérapie de 24 semaines a été mené pour évaluer une gamme de schémas posologiques pour Onglyza. Les patients naïfs de traitement et souffrant d'un diabète insuffisamment contrôlé (A1C â ‰ ¥ 7% à â ‰ ¤ 10%) ont suivi un régime à simple insu de 2 semaines, de l'exercice et une période d'introduction du placebo. Au total, 365 patients ont été randomisés à 2,5 mg tous les matins, 5 mg tous les matins, 2,5 mg avec titration possible à 5 mg tous les matins, ou 5 mg tous les soirs d'Onglyza ou placebo. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours de l'étude ont été traités avec une thérapie de sauvetage à la metformine ajoutée à un placebo ou à Onglyza; le nombre de patients randomisés par groupe de traitement variait de 71 à 74.
Le traitement par Onglyza 5 mg tous les matins ou 5 mg tous les soirs a fourni des améliorations significatives de l'A1C par rapport au placebo (réductions moyennes corrigées du placebo de -0,4% et -0,3%, respectivement). Le traitement par Onglyza 2,5 mg tous les matins a également entraîné une amélioration significative de l'A1C par rapport au placebo (réduction moyenne corrigée du placebo de -0,4%).
Thérapie combinée
Thérapie combinée complémentaire avec la metformine
Au total, 743 patients atteints de diabète de type 2 ont participé à cet essai randomisé en double aveugle de 24 semaines contrôlé par placebo pour évaluer efficacité et innocuité d'Onglyza en association avec la metformine chez les patients avec un contrôle glycémique insuffisant (A1C â ‰ ¥ 7% et â ‰ ¤ 10%) sous metformine seul. Pour être admissibles à l'inscription, les patients devaient prendre une dose stable de metformine (1500-2550 mg par jour) pendant au moins 8 semaines.
Les patients qui remplissaient les critères d'éligibilité ont été inclus dans un placebo en simple aveugle, de 2 semaines, diététique et d'exercice. période pendant laquelle les patients ont reçu de la metformine à leur dose de pré-étude, jusqu'à 2500 mg par jour, pour la durée de la étude. Après la période d'introduction, les patients éligibles ont été randomisés à 2,5 mg, 5 mg ou 10 mg d'Onglyza ou d'un placebo en plus de leur dose actuelle de metformine en ouvert. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours de l'étude ont été traités par une thérapie de secours à la pioglitazone, ajoutée aux médicaments existants de l'étude. Les titrages posologiques d'Onglyza et de metformine n'étaient pas autorisés.
Onglyza 2,5 mg et 5 mg d'add-on à la méformine ont apporté des améliorations significatives en A1C, FPG et PPG par rapport à l'adjonction placebo à la metformine (tableau 4). Les changements moyens par rapport à la ligne de base pour A1C au fil du temps et au point final sont illustrés à la figure 1. La proportion de patients qui ont arrêté pour manque de contrôle glycémique ou qui ont été secourus pour répondre aux critères glycémiques prédéfinis était de 15% dans le groupe Onglyza 2,5 mg add-on au groupe metformine, 13% dans le groupe Onglyza 5 mg add-on au groupe metformine et 27% dans le groupe placebo placebo à la metformine groupe.
Tableau 4: Paramètres glycémiques à la semaine 24 dans une étude contrôlée par placebo d'Onglyza en tant que thérapie combinée complémentaire avec la metformine *
| Paramètre d'efficacité | Onglyza 2,5 mg + Metformine N = 192 |
Onglyza 5 mg + Metformine N = 191 |
Placebo + Metformine N = 179 |
|---|---|---|---|
| * Population en intention de traiter utilisant la dernière observation de l'étude ou la dernière observation avant le traitement de secours à la pioglitazone pour les patients nécessitant un sauvetage. | |||
| †Moyenne des moindres carrés ajustée pour la valeur de base. | |||
| c Valeur p <0,0001 par rapport au placebo + metformine | |||
| § valeur p <0,05 par rapport au placebo + metformine | |||
| Hémoglobine a1c (%) | N = 186 | N = 186 | N = 175 |
| Référence (moyenne) | 8.1 | 8.1 | 8.1 |
| Changement par rapport à la référence (moyenne ajustée†) | −0.6 | −0.7 | +0.1 |
| Différence par rapport au placebo (moyenne ajustée†) | −0.7c | −0.8c | |
| Intervalle de confiance à 95% | (−0.9, −0.5) | (−1.0, −0.6) | |
| Pourcentage de patients atteignant A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Glucose plasmatique à jeun (mg / dL) | N = 188 | N = 187 | N = 176 |
| Référence (moyenne) | 174 | 179 | 175 |
| Changement par rapport à la référence (moyenne ajustée†) | −14 | −22 | +1 |
| Différence par rapport au placebo (moyenne ajustée†) | −16 § | −23 § | |
| Intervalle de confiance à 95% | (−23, −9) | (−30, −16) | |
| Glucose postprandial de 2 heures (mg / dL) | N = 155 | N = 155 | N = 135 |
| Référence (moyenne) | 294 | 296 | 295 |
| Changement par rapport à la référence (moyenne ajustée†) | −62 | −58 | −18 |
| Différence par rapport au placebo (moyenne ajustée†) | −44 § | −40 § | |
| Intervalle de confiance à 95% | (−60, −27) | (−56, −24) |
Figure 1: Variation moyenne par rapport à l'inclusion dans A1C dans un essai contrôlé par placebo d'Onglyza en tant que thérapie combinée complémentaire avec la metformine *
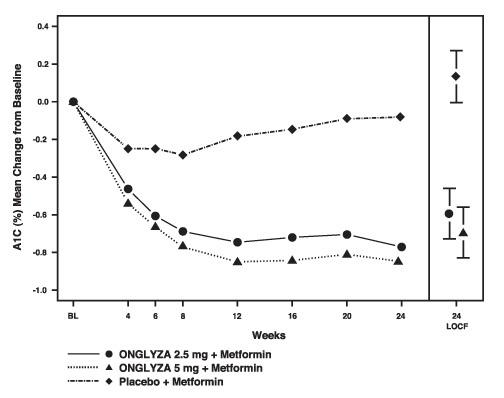
* Comprend les patients avec une valeur de référence et à la semaine 24.
La semaine 24 (LOCF) comprend la population en intention de traiter en utilisant la dernière observation de l'étude avant le traitement de secours à la pioglitazone pour les patients nécessitant un sauvetage. La variation moyenne par rapport à la ligne de base est ajustée pour la valeur de base.
Thérapie combinée complémentaire avec une thiazolidinedione
Au total, 565 patients atteints de diabète de type 2 ont participé à cet essai randomisé, en double aveugle, contrôlé par placebo, d'une durée de 24 semaines, pour évaluer l'efficacité et l'innocuité d'Onglyza en association avec une thiazolidinedione (TZD) chez les patients dont le contrôle glycémique est insuffisant (A1C â ‰ ¥ 7% à â ‰ ¤10,5%) TZD seul. Pour être admissibles à l'inscription, les patients devaient prendre une dose stable de pioglitazone (30 à 45 mg une fois par jour) ou rosiglitazone (4 mg une fois par jour ou 8 mg soit une fois par jour soit en deux doses fractionnées de 4 mg) pendant au moins 12 semaines.
Les patients qui remplissaient les critères d'éligibilité ont été inscrits à un régime en simple aveugle de 2 semaines période d'introduction du placebo au cours de laquelle les patients ont reçu le TZD à leur dose pré-étude pendant la étude. Après la période d'introduction, les patients éligibles ont été randomisés à 2,5 mg ou 5 mg d'Onglyza ou d'un placebo en plus de leur dose actuelle de TZD. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours de l'étude ont été traités par sauvetage à la metformine, ajouté aux médicaments de l'étude existants. La titration de la dose d'Onglyza ou de TZD n'a pas été autorisée pendant l'étude. Un changement dans le régime de TZD de la rosiglitazone à la pioglitazone à des doses thérapeutiques équivalentes spécifiées a été autorisé à la discrétion de l'investigateur s'il est jugé médicalement approprié.
Onglyza 2,5 mg et 5 mg d'add-on au TZD ont apporté des améliorations significatives dans A1C, FPG et PPG par rapport à l'adjonction de placebo au TZD (Tableau 5). La proportion de patients qui ont arrêté pour manque de contrôle glycémique ou qui ont été secourus pour répondre à des critères glycémiques prédéfinis était de 10% dans le complément Onglyza 2,5 mg au groupe TZD, 6% pour le complément Onglyza 5 mg au groupe TZD et 10% dans le complément placebo au TZD groupe.
Tableau 5: Paramètres glycémiques à la semaine 24 dans une étude contrôlée par placebo d'Onglyza en tant que thérapie combinée complémentaire avec une thiazolidinedione *
| Paramètre d'efficacité | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Placebo + TZD N = 184 |
|---|---|---|---|
| * Population en intention de traiter utilisant la dernière observation de l'étude ou la dernière observation avant le traitement de sauvetage à la metformine pour les patients nécessitant un sauvetage. | |||
| †Moyenne des moindres carrés ajustée pour la valeur de base. | |||
| c Valeur p <0,0001 par rapport au placebo + TZD | |||
| § Valeur p <0,05 par rapport au placebo + TZD | |||
| Hémoglobine a1c (%) | N = 192 | N = 183 | N = 180 |
| Référence (moyenne) | 8.3 | 8.4 | 8.2 |
| Changement par rapport à la référence (moyenne ajustée†) | −0.7 | −0.9 | −0.3 |
| Différence par rapport au placebo (moyenne ajustée†) | −0.4 § | −0.6c | |
| Intervalle de confiance à 95% | (−0.6, −0.2) | (−0.8, −0.4) | |
| Pourcentage de patients atteignant A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Glucose plasmatique à jeun (mg / dL) | N = 193 | N = 185 | N = 181 |
| Référence (moyenne) | 163 | 160 | 162 |
| Changement par rapport à la référence (moyenne ajustée†) | −14 | −17 | −3 |
| Différence par rapport au placebo (moyenne ajustée†) | −12 § | −15 § | |
| Intervalle de confiance à 95% | (−20, −3) | (−23, −6) | |
| Glucose postprandial de 2 heures (mg / dL) | N = 156 | N = 134 | N = 127 |
| Référence (moyenne) | 296 | 303 | 291 |
| Changement par rapport à la référence (moyenne ajustée†) | −55 | −65 | −15 |
| Différence par rapport au placebo (moyenne ajustée†) | −40 § | −50 § | |
| Intervalle de confiance à 95% | (−56, −24) | (−66, −34) |
Thérapie combinée complémentaire avec du glyburide
Au total, 768 patients atteints de diabète de type 2 ont participé à cet essai randomisé, en double aveugle, contrôlé par placebo, d'une durée de 24 semaines, pour évaluer l'efficacité et l'innocuité d'Onglyza en association avec une sulfonylurée (SU) chez les patients dont le contrôle glycémique est insuffisant lors de l'inscription (A1C â 7,5 ¥ à 10 ¤ 10%) sur une dose sous-maximale de SU seul. Pour être admissibles à l'inscription, les patients devaient prendre une dose sous-maximale de SU pendant 2 mois ou plus. Dans cette étude, Onglyza en association avec une dose fixe et intermédiaire de SU a été comparé au titrage à une dose plus élevée de SU.
Les patients qui remplissaient les critères d'éligibilité ont été enrôlés en simple aveugle, pendant 4 semaines, pendant la période d'alimentation et d'exercice, et placés sous glyburide 7,5 mg une fois par jour. Après la période d'introduction, les patients éligibles avec A1C â ‰ ¥ 7% à â € 10% ont été randomisés à 2,5 mg ou 5 mg de complément Onglyza à 7,5 mg de glyburide ou à un placebo plus une dose quotidienne totale de 10 mg de glyburide. Les patients ayant reçu un placebo étaient éligibles pour une augmentation du glyburide à une dose quotidienne totale de 15 mg. La sur-titration du glyburide n'était pas autorisée chez les patients ayant reçu Onglyza 2,5 mg ou 5 mg. Le glyburide a pu être revu à la baisse dans n'importe quel groupe de traitement une fois au cours de la période d'étude de 24 semaines en raison d'une hypoglycémie jugée nécessaire par l'investigateur. Environ 92% des patients du groupe placebo plus glyburide ont été augmentés à une dose quotidienne totale finale de 15 mg au cours des 4 premières semaines de la période d'étude. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours de l'étude ont été traités par sauvetage à la metformine, ajouté aux médicaments de l'étude existants. La titration de la dose d'Onglyza n'a pas été autorisée pendant l'étude.
En association avec le glyburide, Onglyza 2,5 mg et 5 mg ont apporté des améliorations significatives en A1C, FPG et PPG par rapport au placebo plus le groupe glyburide surévalué (Tableau 6). La proportion de patients qui ont arrêté pour manque de contrôle glycémique ou qui ont été secourus pour répondre aux critères glycémiques pré-spécifiés était de 18% en le groupe Onglyza 2,5 mg au groupe glyburide, 17% dans le groupe Onglyza 5 mg au groupe glyburide et 30% dans le placebo plus le glyburide surévalué groupe.
Tableau 6: Paramètres glycémiques à la semaine 24 dans une étude contrôlée par placebo d'Onglyza en tant que thérapie combinée complémentaire avec le glyburide *
| Paramètre d'efficacité | Onglyza 2,5 mg + Glyburide 7,5 mg N = 248 |
Onglyza 5 mg + Glyburide 7,5 mg N = 253 |
Placebo + Glyburide surclassé N = 267 |
|---|---|---|---|
| * Population en intention de traiter utilisant la dernière observation de l'étude ou la dernière observation avant le traitement de sauvetage à la metformine pour les patients nécessitant un sauvetage. | |||
| †Moyenne des moindres carrés ajustée pour la valeur de base. | |||
| c Valeur p <0,0001 par rapport au placebo + glyburide surclassé | |||
| § Valeur p <0,05 par rapport au placebo + glyburide surévalué | |||
| Hémoglobine a1c (%) | N = 246 | N = 250 | N = 264 |
| Référence (moyenne) | 8.4 | 8.5 | 8.4 |
| Changement par rapport à la référence (moyenne ajustée†) | −0.5 | −0.6 | +0.1 |
| Différence par rapport au glyburide majoré (moyenne ajustée†) | −0.6c | −0.7c | |
| Intervalle de confiance à 95% | (−0.8, −0.5) | (−0.9, −0.6) | |
| Pourcentage de patients atteignant A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Glucose plasmatique à jeun (mg / dL) | N = 247 | N = 252 | N = 265 |
| Référence (moyenne) | 170 | 175 | 174 |
| Changement par rapport à la référence (moyenne ajustée†) | −7 | −10 | +1 |
| Différence par rapport au glyburide majoré (moyenne ajustée†) | −8 § | −10 § | |
| Intervalle de confiance à 95% | (−14, −1) | (−17, −4) | |
| Glucose postprandial de 2 heures (mg / dL) | N = 195 | N = 202 | N = 206 |
| Référence (moyenne) | 309 | 315 | 323 |
| Changement par rapport à la référence (moyenne ajustée†) | −31 | −34 | +8 |
| Différence par rapport au glyburide majoré (moyenne ajustée†) | −38 § | −42 § | |
| Intervalle de confiance à 95% | (−50, −27) | (−53, −31) |
Co-administration de metformine chez des patients naïfs de traitement
Au total, 1306 patients naïfs de traitement atteints de diabète sucré de type 2 ont participé à cet essai contrôlé par placebo, randomisé, en double aveugle, de 24 semaines évaluer l'efficacité et l'innocuité d'Onglyza co-administré avec de la metformine chez des patients dont le contrôle glycémique est insuffisant (A1C â ‰ ¥ 8% à â ‰ ¤ 12%) sur l'alimentation et l'exercice seul. Les patients devaient être naïfs de traitement pour être inclus dans cette étude.
Les patients qui remplissaient les critères d'éligibilité ont été inscrits dans une période d'introduction d'un placebo à simple insu, d'une semaine, diététique et d'exercice. Les patients ont été randomisés dans l'un des quatre bras de traitement: Onglyza 5 mg + metformine 500 mg, saxagliptine 10 mg + metformine 500 mg, saxagliptine 10 mg + placebo ou metformine 500 mg + placebo. Onglyza a été administré une fois par jour. Dans les 3 groupes de traitement utilisant de la metformine, la dose de metformine a été augmentée chaque semaine par incréments de 500 mg par jour, comme toléré, jusqu'à un maximum de 2000 mg par jour sur la base du FPG. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours des études ont été traités par sauvetage à la pioglitazone comme traitement d'appoint.
L'administration concomitante d'Onglyza 5 mg plus metformine a fourni des améliorations significatives de A1C, FPG et PPG par rapport au placebo plus metformine (Tableau 7).
Tableau 7: Paramètres glycémiques à la semaine 24 dans un essai contrôlé par placebo de la co-administration d'Onglyza avec la metformine chez des patients naïfs de traitement
| Paramètre d'efficacité | Onglyza 5 mg + Metformine N = 320 |
Placebo + Metformine N = 328 |
|---|---|---|
| * Population en intention de traiter utilisant la dernière observation de l'étude ou la dernière observation avant le traitement de secours à la pioglitazone pour les patients nécessitant un sauvetage. | ||
| †Moyenne des moindres carrés ajustée pour la valeur de base. | ||
| c Valeur p <0,0001 par rapport au placebo + metformine | ||
| § valeur p <0,05 par rapport au placebo + metformine | ||
| Hémoglobine a1c (%) | N = 306 | N = 313 |
| Référence (moyenne) | 9.4 | 9.4 |
| Changement par rapport à la référence (moyenne ajustée†) | −2.5 | −2.0 |
| Différence par rapport au placebo + metformine (moyenne ajustée†) | −0.5c | |
| Intervalle de confiance à 95% | (−0.7, −0.4) | |
| Pourcentage de patients atteignant A1C <7% | 60% §(185/307) | 41% (129/314) |
| Glucose plasmatique à jeun (mg / dL) | N = 315 | N = 320 |
| Référence (moyenne) | 199 | 199 |
| Changement par rapport à la référence (moyenne ajustée†) | −60 | −47 |
| Différence par rapport au placebo + metformine (moyenne ajustée†) | −13 § | |
| Intervalle de confiance à 95% | (−19, −6) | |
| Glucose postprandial de 2 heures (mg / dL) | N = 146 | N = 141 |
| Référence (moyenne) | 340 | 355 |
| Changement par rapport à la référence (moyenne ajustée†) | −138 | −97 |
| Différence par rapport au placebo + metformine (moyenne ajustée†) | −41 § | |
| Intervalle de confiance à 95% | (−57, −25) |
Haut
Comment fournie
Les comprimés Onglyza ™ (saxagliptine) ont des marques sur les deux faces et sont disponibles dans les dosages et les emballages énumérés dans le tableau 8.
| Tablette Force |
Comprimé pelliculé Couleur / forme |
Tablette Marquages |
Taille du paquet | Code NDC |
|---|---|---|---|---|
| 5 mg | rose biconvexe, rond |
"5" sur un côté et "4215" sur le revers, à l'encre bleue | Bouteilles de 30 Bouteilles de 90 Bouteilles de 500 Blister de 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | jaune pâle à jaune clair biconvexe, rond |
"2.5" sur un côté et "4214" sur le revers, à l'encre bleue | Bouteilles de 30 Bouteilles de 90 |
0003-4214-11 0003-4214-21 |
Stockage et manutention
Conserver à 20 ° -25 ° C (68 ° -77 ° F); excursions permises à 15 ° -30 ° C (59 ° -86 ° F) [voir USP Controlled Room Temperature].
Haut
Dernière mise à jour: 07/09
E.R. Squibb & Sons, L.L.C.
Informations patient Onglyza
Informations détaillées sur les signes, les symptômes, les causes et les traitements du diabète
Les informations contenues dans cette monographie ne sont pas destinées à couvrir toutes les utilisations, directions, précautions, interactions médicamenteuses ou effets indésirables possibles. Ces informations sont généralisées et ne sont pas destinées à un avis médical spécifique. Si vous avez des questions sur les médicaments que vous prenez ou si vous souhaitez plus d'informations, consultez votre médecin, votre pharmacien ou votre infirmière.
retour à: Parcourir tous les médicaments pour le diabète

