Byetta pour le traitement du diabète
Nom de la marque: Byetta
Nom générique: exénatide
Forme posologique: injection
Contenu:
La description
Pharmacologie clinique
Etudes cliniques
Indications et usage
Contre-indications
Précautions
Effets indésirables
Surdosage
Dosage et administration
Espace de rangement
Comment fournie
Byetta (Exenatide) Information pour les patients (en anglais simple)
La description
Byetta® (exénatide) est un peptide synthétique qui a des actions mimétiques incrétine et a été initialement identifié dans le lézard Heloderma suspectum. Byetta améliore la sécrétion d'insuline dépendante du glucose par les cellules bêta pancréatiques, supprime la sécrétion de glucagon élevée de manière inappropriée et ralentit la vidange gastrique. L'exénatide diffère par sa structure chimique et son action pharmacologique de l'insuline, des sulfonylurées (y compris Dérivés de D-phénylalanine et méglitinides), biguanides, thiazolidinediones et alpha-glucosidase inhibiteurs.
L'exénatide est un amide peptidique à 39 acides aminés. L'exénatide a la formule empirique C
H - His - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gin - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Ser - NH2
Byetta est fourni pour une injection sous-cutanée (SC) sous forme de solution isotonique stérile conservée dans une cartouche en verre qui a été assemblée dans un stylo-injecteur (stylo). Chaque millilitre (mL) contient 250 microgrammes (mcg) d'exénatide synthétique, 2,2 mg de métacrésol comme conservateur antimicrobien, le mannitol comme agent d'ajustement de la tonicité, et acide acétique glacial et acétate de sodium trihydraté dans de l'eau pour injection sous forme de solution tampon à pH 4,5. Deux stylos préremplis sont disponibles pour délivrer des doses unitaires de 5 mcg ou 10 mcg. Chaque stylo prérempli délivrera 60 doses pour fournir 30 jours d'administration deux fois par jour (BID).
Haut
Pharmacologie clinique
Mécanisme d'action
Les incrétines, comme le glucagon-like peptide-1 (GLP-1), améliorent la sécrétion d'insuline glucose-dépendante et présentent d'autres actions antihyperglycémiques après leur libération dans la circulation intestinale. L'exénatide est un agent mimétique de l'incrétine qui imite l'augmentation de la sécrétion d'insuline glucose-dépendante et plusieurs autres actions antihyperglycémiques des incrétines.
La séquence d'acides aminés de l'exénatide chevauche partiellement celle du GLP-1 humain. Il a été démontré que l'exénatide se lie et active le récepteur connu du GLP-1 humain in vitro. Cela conduit à une augmentation de la synthèse d'insuline dépendante du glucose et de la sécrétion in vivo d'insuline. à partir de cellules bêta pancréatiques, par des mécanismes impliquant l'AMP cyclique et / ou d'autres signaux intracellulaires voies. L'exénatide favorise la libération d'insuline par les cellules bêta en présence de concentrations élevées de glucose. Lorsqu'il est administré in vivo, l'exénatide imite certaines actions antihyperglycémiques du GLP-1.
Byetta améliore le contrôle glycémique en réduisant les concentrations de glucose à jeun et postprandiales chez les patients atteints de diabète de type 2 grâce aux actions décrites ci-dessous.
Sécrétion d'insuline dépendante du glucose: Byetta a des effets aigus sur la réactivité des cellules bêta pancréatiques au glucose et conduit à la libération d'insuline uniquement en présence de concentrations élevées de glucose. Cette sécrétion d'insuline diminue à mesure que les concentrations de glucose dans le sang diminuent et approchent de l'euglycémie.
Réponse à l'insuline de première phase: Chez les individus en bonne santé, une sécrétion d'insuline robuste se produit pendant les 10 premières minutes suivant l'administration intraveineuse (IV) de glucose. Cette sécrétion, connue sous le nom de «réponse insulinique de première phase», est généralement absente chez les patients atteints de diabète de type 2. La perte de la réponse d'insuline de première phase est un défaut précoce des cellules bêta dans le diabète de type 2. L'administration de Byetta à des concentrations plasmatiques thérapeutiques a rétabli la réponse d'insuline de première phase à un bolus IV de glucose chez les patients atteints de diabète de type 2 (figure 1). La sécrétion d'insuline de première phase et la sécrétion d'insuline de deuxième phase ont été significativement augmentées chez les patients atteints de diabète de type 2 traités par Byetta par rapport au sérum physiologique (p
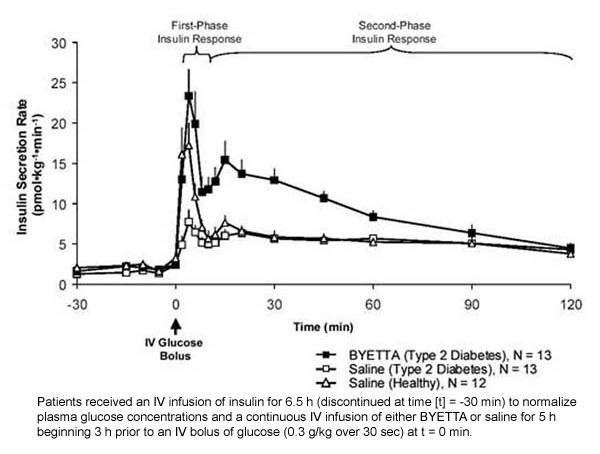
Figure 1: Taux moyen (+ SEM) de sécrétion d'insuline pendant la perfusion de Byetta ou de solution saline chez les patients atteints de diabète de type 2 et pendant la perfusion de solution saline chez des sujets sains
Sécrétion de glucagon: Chez les patients atteints de diabète de type 2, Byetta modère la sécrétion de glucagon et diminue les concentrations sériques de glucagon pendant les périodes d'hyperglycémie. Des concentrations de glucagon plus faibles entraînent une diminution de la production de glucose hépatique et une diminution de la demande d'insuline. Cependant, Byetta n'altère pas la réponse normale du glucagon à l'hypoglycémie.
Vidange gastrique: Byetta ralentit la vidange gastrique, réduisant ainsi la vitesse à laquelle le glucose dérivé des repas apparaît dans la circulation.
Prise alimentaire: Chez l'animal comme chez l'homme, il a été démontré que l'administration d'exénatide réduit la prise alimentaire.
Pharmacocinétique
Absorption
Après administration SC aux patients atteints de diabète de type 2, l'exénatide atteint les concentrations plasmatiques maximales médianes en 2,1 h. Concentration moyenne maximale d'exénatide (Cmax) était de 211 pg / mL et l'aire moyenne globale sous la courbe (AUC0-inf) était de 1036 pg-h / mL après l'administration par voie SC d'une dose de 10 mcg de Byetta. L'exposition à l'exénatide (ASC) a augmenté proportionnellement sur la plage de doses thérapeutiques de 5 mcg à 10 mcg. Les valeurs Cmax ont augmenté moins que proportionnellement sur la même plage. Une exposition similaire est obtenue avec l'administration SC de Byetta dans l'abdomen, la cuisse ou le bras.
Distribution
Le volume de distribution apparent moyen de l'exénatide après l'administration par voie SC d'une dose unique de Byetta est de 28,3 L.
Métabolisme et élimination
Des études non cliniques ont montré que l'exénatide est principalement éliminé par filtration glomérulaire avec dégradation protéolytique ultérieure. La clairance apparente moyenne de l'exénatide chez l'homme est de 9,1 L / h et la demi-vie terminale moyenne est de 2,4 h. Ces caractéristiques pharmacocinétiques de l'exénatide sont indépendantes de la dose. Chez la plupart des individus, les concentrations d'exénatide sont mesurables environ 10 h après l'administration.
Populations spéciales
Insuffisance rénale
Chez les patients présentant une insuffisance rénale légère à modérée (clairance de la créatinine de 30 à 80 ml / min), la clairance de l'exénatide n'a été que légèrement réduite; par conséquent, aucun ajustement posologique de Byetta n'est nécessaire chez les patients présentant une insuffisance rénale légère à modérée. Cependant, chez les patients atteints d'insuffisance rénale terminale sous dialyse, la clairance moyenne de l'exénatide est réduite à 0,9 L / h contre 9,1 L / h chez les sujets sains (voir PRÉCAUTIONS, Général).
Insuffisance hépatique
Aucune étude pharmacocinétique n'a été réalisée chez des patients présentant un diagnostic d'insuffisance hépatique aiguë ou chronique. Étant donné que l'exénatide est éliminé principalement par les reins, la dysfonction hépatique ne devrait pas affecter les concentrations sanguines d'exénatide (voir Pharmacocinétique, Métabolisme et élimination).
Gériatrique
L'analyse pharmacocinétique de population des patients (de 22 à 73 ans) suggère que l'âge n'influence pas les propriétés pharmacocinétiques de l'exénatide.
Pédiatrique
L'exénatide n'a pas été étudié chez les patients pédiatriques.
Le sexe
L'analyse pharmacocinétique de population des patients masculins et féminins suggère que le sexe n'influence pas la distribution et l'élimination de l'exénatide.
Course
L'analyse pharmacocinétique de population de patients, y compris caucasiens, hispaniques et noirs, suggère que la race n'a pas d'influence significative sur la pharmacocinétique de l'exénatide.
Obésité
L'analyse pharmacocinétique de population des patients obèses (IMC 30 ¥ 30 kg / m2) et non obèses suggère que l'obésité n'a pas d'effet significatif sur la pharmacocinétique de l'exénatide.
Interactions médicamenteuses
Digoxine
L'administration concomitante de doses répétées de Byetta (10 mcg BID) a diminué le Cmax de digoxine orale (0,25 mg QD) de 17% et retardé le Tmax d'environ 2,5 h; cependant, l'exposition pharmacocinétique (ASC) à l'état d'équilibre globale n'a pas été modifiée.
Lovastatine
L'ASC et la Cmax de la lovastatine ont diminué respectivement d'environ 40% et 28% et le Tmax a été retardé d'environ 4 h lorsque Byetta (10 mcg 2 fois / jour) a été administré en association avec une dose unique de lovastatine (40 mg) par rapport à la lovastatine administrée seul. Dans les essais cliniques contrôlés de 30 semaines de Byetta, l'utilisation de Byetta chez des patients recevant déjà du HMG Les inhibiteurs de la CoA réductase n'étaient pas associés à des changements cohérents des profils lipidiques référence.
Lisinopril
Chez les patients atteints d'hypertension légère à modérée stabilisée sous lisinopril (5 à 20 mg / jour), Byetta (10 mcg BID) n'a pas modifié la Cmax ou l'ASC à l'état d'équilibre du lisinopril. Lisinopril à l'état d'équilibre Tmax a été retardé de 2 h. Il n'y a eu aucun changement dans la pression artérielle systolique et diastolique moyenne sur 24 h.
Acétaminophène
Lorsque 1000 mg d'élixir d'acétaminophène ont été administrés avec 10 mcg de Byetta (0 h) et 1 h, 2 h et 4 h après l'injection de Byetta, les ASC de l'acétaminophène ont diminué de 21%, 23%, 24% et 14%, respectivement; Cmax a diminué respectivement de 37%, 56%, 54% et 41%; Tmax est passée de 0,6 h pendant la période de contrôle à 0,9 h, 4,2 h, 3,3 h et 1,6 h, respectivement. Acétaminophène AUC, Cmax et Tmax n'ont pas été significativement modifiés lorsque l'acétaminophène a été administré 1 h avant l'injection de Byetta.
Warfarine
L'administration concomitante de doses répétées de Byetta (5 mcg BID les jours 1-2 et 10 mcg BID les jours 3-9) chez des volontaires sains a retardé la warfarine (25 mg) Tmax d'environ 2 h. Aucun effet cliniquement significatif sur la Cmax ou l'ASC des énantiomères S et R de la warfarine n'a été observé. Byetta n'a pas modifié les propriétés pharmacodynamiques (évaluées par la réponse INR) de la warfarine.
Pharmacodynamique
Glucose postprandial
Chez les patients atteints de diabète de type 2, Byetta réduit les concentrations plasmatiques de glucose postprandiales (figure 2).
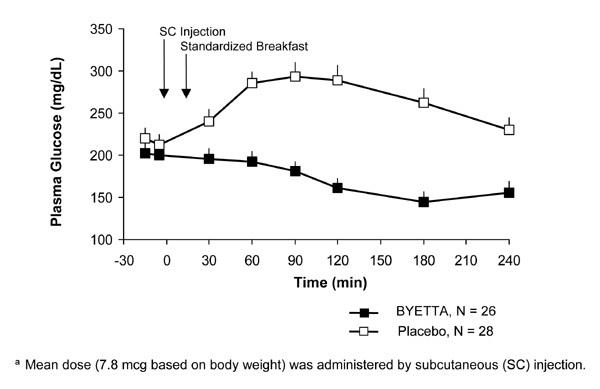
Figure 2: Concentrations moyennes (+ SEM) de glucose plasmatique postprandiales au jour 1 de Byettaune Traitement chez les patients atteints de diabète de type 2 traités par la metformine, une sulfonylurée ou les deux (N = 54)
Glycémie à jeun
Dans une étude croisée à dose unique chez des patients atteints de diabète de type 2 et d'hyperglycémie à jeun, une libération immédiate d'insuline a suivi l'injection de Byetta. Les concentrations plasmatiques de glucose ont été significativement réduites avec Byetta par rapport au placebo (figure 3).
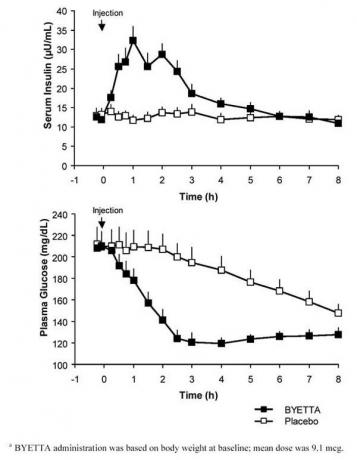
Figure 3: Concentrations moyennes (+ SEM) d'insuline sérique et de glucose plasmatique après une injection unique de Byettaune ou placebo chez les patients à jeun atteints de diabète de type 2 (N = 12)
Haut
Etudes cliniques
Utilisation avec de la metformine et / ou une sulfonylurée
Trois essais contrôlés par placebo en double aveugle de 30 semaines ont été menés pour évaluer l'innocuité et l'efficacité de Byetta chez des patients 2 diabète dont le contrôle glycémique était insuffisant avec la metformine seule, une sulfonylurée seule ou la metformine en association avec un sulfonylurée.
Au total, 1446 patients ont été randomisés dans ces trois essais: 991 (68,5%) étaient de race blanche, 224 (15,5%) étaient hispaniques et 174 (12,0%) étaient noirs. Les valeurs moyennes d'HbA1c au départ pour les essais variaient de 8,2% à 8,7%. Après une période d'introduction de placebo de 4 semaines, les patients ont été randomisés pour recevoir Byetta 5 mcg BID, Byetta 10 mcg BID, ou placebo BID avant les repas du matin et du soir, en plus de leur antidiabétique oral existant agent. Tous les patients assignés à Byetta ont commencé une période d'initiation du traitement avec 5 mcg BID pendant 4 semaines. Après 4 semaines, ces patients ont continué à recevoir Byetta 5 mcg BID ou ont vu leur dose augmentée à 10 mcg BID. Les patients assignés au placebo ont reçu un placebo BID tout au long de l'étude.
Le critère d'évaluation principal dans chaque étude était le changement moyen par rapport à l'HbA de base1c à 30 semaines. Les résultats de l'étude sur trente semaines sont résumés dans le tableau 1.
Tableau 1: Résultats des essais contrôlés par placebo de trente semaines sur Byetta chez des patients dont le contrôle glycémique est insuffisant malgré l'utilisation de metformine, d'une sulfonylurée ou des deux
| Placebo OFFRE |
Byetta 5 mcg BID |
Byetta 10 mcg* OFFRE |
|
|---|---|---|---|
| |||
| En combinaison avec la metformine | |||
| Population en intention de traiter (N) | 113 | 110 | 113 |
| HbA1c (%), Signifier | |||
| Référence | 8.2 | 8.3 | 8.2 |
| Changement à la semaine 30 | +0.1 | −0.4†| −0.8c |
| Proportion atteignant l'HbA1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Poids corporel (kg), moyenne | |||
| Référence | 99.9 | 100.0 | 100.9 |
| Changement à la semaine 30 | −0.3 | −1.6†| −2.8c |
| En combinaison avec une sulfonylurée | |||
| Population en intention de traiter (N) | 123 | 125 | 129 |
| HbA1c (%), Signifier | |||
| Référence | 8.7 | 8.5 | 8.6 |
| Changement à la semaine 30 | +0.1 | −0.5†| −0.9c |
| Proportion atteignant l'HbA1c≤7% § | 8.8% | 32.6%†| 41.3%c |
| Poids corporel (kg), moyenne | |||
| Référence | 99.1 | 94.9 | 95.2 |
| Changement à la semaine 30 | −0.6 | −0.9 | −1.6†|
| En combinaison avec la metformine et une sulfonylurée | |||
| Population en intention de traiter (N) | 247 | 245 | 241 |
| HbA1c (%), Signifier | |||
| Référence | 8.5 | 8.5 | 8.5 |
| Changement à la semaine 30 | +0.2 | −0.6c | −0.8c |
| Proportion atteignant l'HbA1c≤7% § | 9.2% | 27.4%c | 33.5%c |
| Poids corporel (kg), moyenne | |||
| Référence | 99.1 | 96.9 | 98.4 |
| Changement à la semaine 30 | −0.9 | −1.6†| −1.6†|
HbA1c
L'ajout de Byetta à un régime de metformine, d'une sulfonylurée ou des deux a entraîné des réductions statistiquement significatives de l'HbA de base1c à la semaine 30 par rapport aux patients recevant un placebo ajouté à ces agents dans les trois essais contrôlés (Tableau 1). De plus, un effet de dose statistiquement significatif a été observé entre les groupes Byetta de 5 mcg et 10 mcg pour le changement par rapport à l'HbA de base1c à la semaine 30 dans les trois études.
Glycémie à jeun et postprandiale
L'utilisation à long terme de Byetta en association avec la metformine, une sulfonylurée ou les deux, a réduit le jeûne et concentrations plasmatiques de glucose postprandiales d'une manière statistiquement significative et dose-dépendante pendant la semaine 30. Une réduction statistiquement significative par rapport aux valeurs initiales des concentrations moyennes de glucose à jeun et postprandiales a été observée à la semaine 30 dans les deux groupes de Byetta par rapport au placebo dans les données combinées des trois groupes contrôlés essais. La variation de la concentration de glucose à jeun à la semaine 30 par rapport à la valeur initiale était de 8 mg / dL pour Byetta 5 mcg BID et de 10 mg / dL pour Byetta 10 mcg BID, contre +12 mg / dL pour le placebo. La variation de la concentration de glucose postprandiale de 2 h après l'administration de Byetta à la semaine 30 avec la ligne de base était de - 63 mg / dL pour 5 mcg BID et - 71 mg / dL pour 10 mcg BID, contre +11 mg / dL pour placebo.
Proportion de patients atteignant l'HbA1c≤7%
Byetta en association avec la metformine, une sulfonylurée, ou les deux, a entraîné une augmentation statistiquement proportion de patients atteignant un taux d'HbA1câ7% à la semaine 30 par rapport aux patients recevant un placebo en association avec ces agents (Tableau 1).
Poids
Dans les trois essais contrôlés, une diminution du poids corporel de base à la semaine 30 a été associée à Byetta 10 mcg BID par rapport au placebo BID chez les patients atteints de diabète de type 2 (Tableau 1).
Résultats cliniques sur un an
La cohorte de 163 patients des essais contrôlés par placebo de 30 semaines qui ont terminé un total de 52 semaines de traitement par Byetta 10 mcg BID a présenté des variations de l'HbA1c par rapport à la valeur initiale de 1,0% et 1,1% à 30 et 52 semaines de traitement, respectivement, avec des changements par rapport à la ligne de base dans la glycémie à jeun de 14,0 mg / dL et 25,3 mg / dL, et des changements de poids corporel de 2,6 kg et 3,6 kg. Cette cohorte avait des valeurs de base similaires à celles de l'ensemble de la population des essais contrôlés.
Utiliser avec une thiazolidinedione
Dans un essai randomisé, en double aveugle, contrôlé par placebo d'une durée de 16 semaines, Byetta (n = 121) ou placebo (n = 112) a été ajouté à traitement par la thiazolidinedione (pioglitazone ou rosiglitazone), avec ou sans metformine, chez les patients atteints de diabète de type 2 contrôle glycémique. La randomisation vers Byetta ou le placebo a été stratifiée selon que les patients recevaient de la metformine. Les patients assignés au placebo ont reçu un placebo BID tout au long de l'étude. Byetta ou un placebo a été injecté par voie sous-cutanée avant les repas du matin et du soir. Soixante-dix-neuf pour cent des patients prenaient une thiazolidinedione et de la metformine et 21% prenaient une thiazolidinedione seule. La majorité des patients (84%) étaient de race blanche, 8% étaient hispaniques et 3% étaient noirs. Les valeurs initiales moyennes d'HbA1c étaient similaires pour Byetta et le placebo (7,9%). Le traitement par Byetta a été initié à une dose de 5 mcg BID pendant 4 semaines puis augmenté à 10 mcg BID pendant 12 semaines supplémentaires.
Les résultats de l'étude de seize semaines sont résumés dans le tableau 2. Comparé au placebo, Byetta a entraîné des réductions statistiquement significatives de l'HbA1c par rapport à la valeur initiale à la semaine 16. Les effets du traitement pour l'HbA1c étaient similaires dans les deux sous-groupes définis par la strate de traitement sous-jacente (thiazolidinediones seules versus thiazolidinediones plus metformine). La variation de la concentration sérique de glucose à jeun de la valeur initiale à la semaine 16 était statistiquement significative par rapport au placebo (21 mg / dl pour Byetta 10 mcg BID contre +4 mg / dl pour le placebo).
Tableau 2: Résultats de l'essai contrôlé par placebo de 16 semaines de Byetta chez des patients dont le contrôle glycémique est insuffisant malgré l'utilisation d'une thiazolidinedione (TZD) ou d'une thiazolidinedione plus metformine
| Placebo OFFRE |
Byetta 10 mcg* OFFRE |
|
|---|---|---|
| ||
| En combinaison avec un TZD ou un TZD plus MET | ||
| Population en intention de traiter (N) | 112 | 121 |
| HbA1c (%), Signifier | ||
| Référence | 7.9 | 7.9 |
| Changement à la semaine 16 | +0.1 | −0.8†|
| Proportion atteignant l'HbA1c≤7%c | 16.2% | 62.3%†|
| Poids corporel (kg), moyenne | ||
| Référence | 96.9 | 97.5 |
| Changement à la semaine 16 | −0.2 | −1.5†|
Haut
Indications et usage
Byetta est indiqué comme traitement d'appoint pour améliorer le contrôle glycémique chez les patients atteints de diabète sucré de type 2 qui prennent de la metformine, une sulfonylurée, un thiazolidinedione, une combinaison de metformine et d'une sulfonylurée, ou une combinaison de metformine et d'une thiazolidinedione, mais n'ont pas atteint une glycémie adéquate contrôle.
Haut
Contre-indications
Byetta est contre-indiqué chez les patients présentant une hypersensibilité connue à l'exénatide ou à l'un des composants du produit.
Haut
Précautions
Général
Byetta ne remplace pas l'insuline chez les patients qui en ont besoin. Byetta ne doit pas être utilisé chez les patients atteints de diabète de type 1 ou pour le traitement de l'acidocétose diabétique.
Les patients peuvent développer des anticorps anti-exénatide après un traitement par Byetta, conformément aux propriétés potentiellement immunogènes des produits pharmaceutiques protéiques et peptidiques. Les patients recevant Byetta doivent être surveillés pour détecter les signes et symptômes de réactions d'hypersensibilité.
Chez une petite proportion de patients, la formation d'anticorps anti-exénatide à des titres élevés pourrait entraîner l'échec de l'amélioration adéquate du contrôle glycémique. En cas d'aggravation du contrôle glycémique ou d'incapacité à atteindre un contrôle glycémique ciblé, un traitement antidiabétique alternatif doit être envisagé.
L'utilisation concomitante de Byetta avec l'insuline, les dérivés de la D-phénylalanine, les méglitinides ou les inhibiteurs de l'alpha-glucosidase n'a pas été étudiée.
Byetta n'est pas recommandé chez les patients atteints d'insuffisance rénale terminale ou d'insuffisance rénale sévère (clairance de la créatinine Pharmacocinétique, Populations spéciales). Chez les patients atteints d'insuffisance rénale terminale recevant une dialyse, des doses uniques de Byetta 5 mcg n'ont pas été bien tolérées en raison d'effets secondaires gastro-intestinaux.
Il y a eu de rares événements spontanément rapportés d'altération de la fonction rénale, y compris une augmentation créatinine, insuffisance rénale, aggravation d'une insuffisance rénale chronique et d'une insuffisance rénale aiguë, nécessitant parfois hémodialyse. Certains de ces événements sont survenus chez des patients recevant un ou plusieurs agents pharmacologiques connus pour affecter état fonctionnel / d'hydratation et / ou chez les patients souffrant de nausées, de vomissements et / ou de diarrhée, avec ou sans déshydratation. Les agents concomitants comprenaient des inhibiteurs de l'enzyme de conversion de l'angiotensine, des anti-inflammatoires non stéroïdiens et des diurétiques. Une réversibilité de la fonction rénale altérée a été observée avec un traitement de soutien et l'arrêt des agents potentiellement responsables, y compris l'exénatide. L'exénatide ne s'est pas révélé être directement néphrotoxique dans les études précliniques ou cliniques.
Byetta n'a pas été étudié chez les patients atteints d'une maladie gastro-intestinale sévère, y compris la gastroparésie. Son utilisation est généralement associée à des effets indésirables gastro-intestinaux, notamment des nausées, des vomissements et de la diarrhée. Par conséquent, l'utilisation de Byetta n'est pas recommandée chez les patients atteints d'une maladie gastro-intestinale sévère. Le développement de douleurs abdominales sévères chez un patient traité par Byetta doit être étudié car il peut être le signe avant-coureur d'une affection grave.
Hypoglycémie
Dans les essais cliniques contrôlés de 30 semaines avec Byetta, un épisode d'hypoglycémie a été enregistré comme événement indésirable si le patient a signalé des symptômes associés à une hypoglycémie accompagnée d'une dose de glucose sanguin ADMINISTRATION).
Tableau 3: Incidence (%) d'hypoglycémie * par traitement antidiabétique concomitant
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Placebo OFFRE |
5 mcg OFFRE |
10 mcg OFFRE |
Placebo OFFRE |
5 mcg OFFRE |
10 mcg OFFRE |
Placebo OFFRE |
5 mcg OFFRE |
10 mcg OFFRE |
|
| Avec metformine | Avec une sulfonylurée | Avec MET / SFU | |||||||
| Byetta et un placebo ont été administrés avant les repas du matin et du soir. | |||||||||
| Abréviations: BID, deux fois par jour; MET / SFU, metformine et sulfonylurée. | |||||||||
| |||||||||
| N | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| Hypoglycémie | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Lorsqu'il est utilisé en complément d'une thiazolidinedione, avec ou sans metformine, l'incidence d'hypoglycémie légère à modérée symptomatique avec Byetta était de 11% contre 7% avec le placebo.
Byetta n'a pas modifié les réponses hormonales contre-régulatrices à l'hypoglycémie induite par l'insuline dans une étude randomisée, en double aveugle, contrôlée chez des sujets sains.
Information pour les patients
Les patients doivent être informés des risques potentiels de Byetta. Les patients doivent également être pleinement informés des pratiques d'autogestion, y compris de l'importance d'un stockage approprié de Byetta, injection technique, calendrier de dosage de Byetta ainsi que des médicaments oraux concomitants, respect de la planification des repas, activité physique régulière, périodique surveillance de la glycémie et test de l'HbA1c, reconnaissance et gestion de l'hypoglycémie et de l'hyperglycémie, et évaluation du diabète complications.
Il faut conseiller aux patientes d'informer leur médecin si elles sont enceintes ou ont l'intention de devenir enceintes.
Chaque dose de Byetta doit être administrée sous forme d'injection SC dans la cuisse, l'abdomen ou le haut du bras à tout moment Période de 60 minutes avant les repas du matin et du soir (ou avant les deux principaux repas de la journée, environ 6 heures ou plus une part). Byetta ne doit pas être administré après un repas. Si une dose est oubliée, le schéma thérapeutique doit être repris comme prescrit avec la prochaine dose programmée.
Le risque d'hypoglycémie est accru lorsque Byetta est utilisé en association avec un agent induisant une hypoglycémie, comme une sulfonylurée. Les symptômes, le traitement et les conditions qui prédisposent au développement de l'hypoglycémie doivent être expliqués au patient. Bien que les instructions habituelles du patient pour la gestion de l'hypoglycémie n'aient pas besoin d'être modifiées, ces instructions doivent être revu et renforcé lors de l'initiation du traitement par Byetta, en particulier en cas d'administration concomitante avec une sulfonylurée (voir PRÉCAUTIONS, Hypoglycémie).
Les patients doivent être informés que le traitement par Byetta peut entraîner une réduction de l'appétit, de la et / ou le poids corporel, et qu'il n'est pas nécessaire de modifier le schéma posologique en raison de ces effets. Le traitement par Byetta peut également entraîner des nausées, en particulier au début du traitement (voir EFFETS INDÉSIRABLES).
Le patient doit lire la notice «Informations pour le patient» et le manuel d'utilisation du stylo avant de commencer le traitement par Byetta et les revoir chaque fois que l'ordonnance est renouvelée. Le patient doit être informé de l'utilisation et du stockage appropriés du stylo, en insistant sur la manière et le moment de configurer un nouveau stylo et en notant qu'une seule étape de configuration est nécessaire lors de la première utilisation. Il faut conseiller au patient de ne pas partager le stylo et les aiguilles.
Les patients doivent être informés que les aiguilles du stylo ne sont pas incluses avec le stylo et doivent être achetées séparément. Les patients doivent être informés de la longueur et du calibre de l'aiguille à utiliser.
Interactions médicamenteuses
L'effet de Byetta sur le ralentissement de la vidange gastrique peut réduire l'étendue et le taux d'absorption des médicaments administrés par voie orale. Byetta doit être utilisé avec prudence chez les patients recevant des médicaments par voie orale qui nécessitent une absorption gastro-intestinale rapide. Pour les médicaments oraux qui dépendent des concentrations seuils d'efficacité, tels que contraceptifs et antibiotiques, il faut conseiller aux patients de prendre ces médicaments au moins 1 h avant Injection de Byetta. Si de tels médicaments doivent être administrés avec de la nourriture, les patients doivent être avisés de les prendre avec un repas ou une collation lorsque Byetta n'est pas administré. L'effet de Byetta sur l'absorption et l'efficacité des contraceptifs oraux n'a pas été caractérisé.
Warfarine
Dans une étude de pharmacologie clinique contrôlée chez des volontaires sains, un retard de la warfarine Tmax d'environ 2 h a été observé lorsque la warfarine était administrée 30 minutes après Byetta. Aucun effet cliniquement significatif sur la Cmax ou l'ASC n'a été observé. Cependant, depuis l'introduction sur le marché, des cas d'augmentation du RIN ont été signalés spontanément. (International Normalized Ratio) avec utilisation concomitante de warfarine et de Byetta, parfois associée à saignement.
Carcinogenèse, mutagenèse, altération de la fertilité
Une étude de cancérogénicité de 104 semaines a été menée chez des rats mâles et femelles à des doses de 18, 70 ou 250 mcg / kg / jour administrées par injection bolus SC. Des adénomes bénins des cellules C de la thyroïde ont été observés chez des rats femelles à toutes les doses d'exénatide. Les incidences chez les rats femelles étaient de 8% et 5% dans les deux groupes témoins et de 14%, 11% et 23% dans les groupes à faible, moyenne et forte dose avec exposition systémique de 5, 22 et 130 fois, respectivement, l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / jour, en fonction de la surface plasmatique sous la courbe (ASC).
Dans une étude de cancérogénicité de 104 semaines chez des souris à des doses de 18, 70 ou 250 mcg / kg / jour administrées par injection bolus SC, aucune preuve de tumeurs n'a été observée à des doses allant jusqu'à 250 mcg / kg / jour, une exposition systémique jusqu'à 95 fois l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / jour, basée sur AUC.
L'exénatide n'était pas mutagène ni clastogène, avec ou sans activation métabolique, dans le test de mutagénicité bactérienne Ames ou le test d'aberration chromosomique dans des cellules ovariennes de hamster chinois. L'exénatide était négatif dans le test du micronoyau de souris in vivo.
Dans les études de fertilité chez la souris avec des doses SC de 6, 68 ou 760 mcg / kg / jour, les mâles ont été traités pendant 4 semaines avant avant et pendant l'accouplement et les femelles ont été traitées 2 semaines avant et pendant l'accouplement jusqu'au jour de la gestation 7. Aucun effet indésirable sur la fertilité n'a été observé à 760 mcg / kg / jour, une exposition systémique 390 fois l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / jour, basée sur l'ASC.
Grossesse
Catégorie de grossesse C
Il a été démontré que l'exénatide provoque une réduction de la croissance fœtale et néonatale et des effets squelettiques chez la souris expositions systémiques 3 fois l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / jour, basé sur l'AUC. Il a été démontré que l'exénatide provoque des effets squelettiques chez le lapin à des expositions systémiques 12 fois l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / jour, sur la base de l'ASC. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Byetta ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Chez les souris femelles ayant reçu des doses SC de 6, 68 ou 760 mcg / kg / jour à partir de 2 semaines avant et pendant l'accouplement jusqu'au 7e jour de gestation, aucun effet fœtal indésirable n'a été observé. effets à des doses allant jusqu'à 760 mcg / kg / jour, expositions systémiques jusqu'à 390 fois l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / jour, basée sur AUC.
Chez les souris gravides ayant reçu des doses SC de 6, 68, 460 ou 760 mcg / kg / jour du 6e au 15e jour de la gestation (organogenèse), fente palatine (certaines avec trous) et squelette irrégulier une ossification des côtes et des os du crâne a été observée à 6 mcg / kg / jour, une exposition systémique 3 fois supérieure à l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / kg / jour, basé sur l'AUC.
Chez les lapines gravides ayant reçu des doses SC de 0,2, 2, 22, 156 ou 260 mcg / kg / jour du 6e au 18e jour de gestation (organogenèse), squelette irrégulier des ossifications ont été observées à 2 mcg / kg / jour, une exposition systémique 12 fois l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / jour, basé sur l'AUC.
Chez les souris gravides ayant reçu des doses SC de 6, 68 ou 760 mcg / kg / jour du jour de gestation 6 au jour 20 de lactation (sevrage), une augmentation du nombre de décès néonatals a été observée. les jours 2 à 4 du postpartum chez les mères ayant reçu 6 mcg / kg / jour, une exposition systémique 3 fois supérieure à l'exposition humaine résultant de la dose maximale recommandée de 20 mcg / jour, basée sur l'ASC.
Mères allaitantes
On ne sait pas si l'exénatide est excrété dans le lait maternel. De nombreux médicaments sont excrétés dans le lait maternel et en raison du potentiel d'effets indésirables cliniquement significatifs de l'exénatide chez les nourrissons allaités, une décision Il faut décider s'il convient d'arrêter de produire du lait pour la consommation ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la lactation. femme. Des études sur des souris allaitantes ont démontré que l'exénatide est présent à de faibles concentrations dans le lait (inférieures ou égales à 2,5% de la concentration dans le plasma maternel après administration sous-cutanée). Il faut être prudent lorsque Byetta est administré à une femme qui allaite.
Utilisation pédiatrique
La sécurité et l'efficacité de Byetta n'ont pas été établies chez les patients pédiatriques.
Utilisation gériatrique
Byetta a été étudié chez 282 patients de 65 ans ou plus et chez 16 patients de 75 ans ou plus. Aucune différence de sécurité ou d'efficacité n'a été observée entre ces patients et les patients plus jeunes.
Haut
Effets indésirables
Utilisation avec de la metformine et / ou une sulfonylurée
Dans les trois essais contrôlés de 30 semaines sur l'adjonction de Byetta à la metformine et / ou à la sulfonylurée, les événements indésirables avec une incidence de 5 ¥ 5% (hors hypoglycémie; voir Tableau 3) qui se sont produits plus fréquemment chez les patients traités par Byetta que chez les patients sous placebo sont résumés dans le tableau 4.
Tableau 4: Événements indésirables fréquents liés au traitement (incidence de 5% et plus d'incidence avec le traitement Byetta), à l'exclusion de l'hypoglycémie *
| Placebo BID N = 483 % |
Tous Byetta BID N = 963 % |
|
|---|---|---|
| ||
| La nausée | 18 | 44 |
| Vomissement | 4 | 13 |
| La diarrhée | 6 | 13 |
| Feeling Jittery | 4 | 9 |
| Vertiges | 6 | 9 |
| Mal de crâne | 6 | 9 |
| Dyspepsie | 3 | 6 |
Les événements indésirables associés à Byetta étaient généralement d'intensité légère à modérée. L'événement indésirable le plus fréquemment rapporté, des nausées légères à modérées, s'est produit de manière dose-dépendante. Avec la poursuite du traitement, la fréquence et la gravité ont diminué au fil du temps chez la plupart des patients qui avaient initialement eu des nausées. Les événements indésirables rapportés chez 1,0 ¥ à <5,0% des patients recevant Byetta et rapportés plus fréquemment qu'avec le placebo inclus asthénie (principalement signalée comme faiblesse), diminution de l'appétit, reflux gastro-œsophagien et hyperhidrose. Les patients dans les études d'extension à 52 semaines ont connu des types d'événements indésirables similaires observés dans les essais contrôlés de 30 semaines.
L'incidence de sevrage en raison d'événements indésirables était de 7% pour les patients traités par Byetta et de 3% pour les patients sous placebo. Les événements indésirables les plus fréquents conduisant au sevrage chez les patients traités par Byetta étaient les nausées (3% des patients) et les vomissements (1%). Chez les patients sous placebo, <1% se sont retirés en raison de nausées et 0% en raison de vomissements.
Utiliser avec une thiazolidinedione
Dans l'étude contrôlée par placebo de 16 semaines sur l'adjonction de Byetta à une thiazolidinedione, avec ou sans metformine, l'incidence et le type de les autres événements indésirables observés étaient similaires à ceux observés dans les essais cliniques contrôlés de 30 semaines avec la metformine et / ou un sulfonylurée. Aucun événement indésirable grave n'a été signalé dans le bras placebo. Deux événements indésirables graves, à savoir des douleurs thoraciques (entraînant un retrait) et une pneumonite d'hypersensibilité chronique, ont été rapportés dans le bras Byetta.
L'incidence du sevrage en raison d'événements indésirables était de 16% (19/121) pour les patients traités par Byetta et de 2% (2/112) pour les patients sous placebo. Les événements indésirables les plus fréquents conduisant au sevrage chez les patients traités par Byetta étaient les nausées (9%) et les vomissements (5%). Pour les patients sous placebo, <1% se sont retirés en raison de nausées. Des frissons (n = 4) et des réactions au point d'injection (n = 2) ne sont survenus que chez les patients traités par Byetta. Les deux patients qui ont signalé une réaction au point d'injection avaient des titres élevés d'anticorps anti-exénatide.
Données spontanées
Depuis l'introduction sur le marché de Byetta, les effets indésirables supplémentaires suivants ont été rapportés. Étant donné que ces événements sont signalés volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation de cause à effet avec l'exposition au médicament.
Général: réactions au point d'injection; dysgueusie; somnolence, l'INR a augmenté avec l'utilisation concomitante de warfarine (certains rapports associés à des saignements).
Allergie / Hypersensibilité: prurit généralisé et / ou urticaire, éruption maculaire ou papuleuse, œdème de Quincke; rares cas de réaction anaphylactique.
Appareil digestif: nausées, vomissements et / ou diarrhée entraînant une déshydratation; distension abdominale, douleur abdominale, éructation, constipation, flatulence, pancréatite aiguë.
Troubles rénaux et urinaires: altération de la fonction rénale, y compris insuffisance rénale aiguë, aggravation de l'insuffisance rénale chronique, insuffisance rénale, augmentation de la créatininémie (voir PRÉCAUTIONS).
Immunogénicité
Conformément aux propriétés potentiellement immunogènes des produits pharmaceutiques protéiques et peptidiques, les patients peuvent développer des anticorps anti-exénatide après un traitement par Byetta. Chez la plupart des patients qui développent des anticorps, les titres d'anticorps diminuent avec le temps.
Dans les essais contrôlés de 30 semaines sur l'adjonction de Byetta à la metformine et / ou à la sulfonylurée, 38% des patients avaient des anticorps anti-exénatide de faible titre à 30 semaines. Pour ce groupe, le niveau de contrôle glycémique (HbA1c) était généralement comparable à celui observé chez ceux sans titres d'anticorps. Un autre 6% des patients avaient des anticorps à titre plus élevé à 30 semaines. Dans environ la moitié de ces 6% (3% du total des patients ayant reçu Byetta dans les études contrôlées de 30 semaines), la réponse glycémique à Byetta a été atténuée; le reste a eu une réponse glycémique comparable à celle des patients sans anticorps.
Dans l'essai de 16 semaines sur l'adjonction de Byetta aux thiazolidinediones, avec ou sans metformine, 9% des patients avaient des anticorps à titre plus élevé à 16 semaines. Par rapport aux patients qui n'ont pas développé d'anticorps contre Byetta, la réponse glycémique des patients avec des anticorps à titre plus élevé a été en moyenne atténuée.
La réponse glycémique du patient à Byetta doit être surveillée. En cas d'aggravation du contrôle glycémique ou d'incapacité à atteindre un contrôle glycémique ciblé, un traitement antidiabétique alternatif doit être envisagé.
Haut
Surdosage
Dans une étude clinique de Byetta, trois patients atteints de diabète de type 2 ont chacun présenté une surdose unique de 100 mcg SC (10 fois la dose maximale recommandée). Les effets des surdoses comprenaient des nausées sévères, des vomissements sévères et une baisse rapide des concentrations de glucose dans le sang. Un des trois patients a présenté une hypoglycémie sévère nécessitant une administration parentérale de glucose. Les trois patients se sont rétablis sans complication. En cas de surdosage, un traitement de soutien approprié doit être instauré en fonction des signes et symptômes cliniques du patient.
Haut
Dosage et administration
Le traitement par Byetta doit être initié à 5 mcg par dose administrée deux fois par jour à tout moment dans les 60 minutes période avant les repas du matin et du soir (ou avant les deux principaux repas de la journée, environ 6 heures ou plus une part). Byetta ne doit pas être administré après un repas. Sur la base de la réponse clinique, la dose de Byetta peut être augmentée à 10 mcg deux fois par jour après 1 mois de traitement. Chaque dose doit être administrée sous forme d'injection SC dans la cuisse, l'abdomen ou le haut du bras.
Byetta est recommandé chez les patients atteints de diabète sucré de type 2 qui reçoivent déjà de la metformine, une sulfonylurée, un thiazolidinedione, une combinaison de metformine et d'une sulfonylurée, ou une combinaison de metformine et d'une thiazolidinedione, et ont un taux sous-optimal contrôle glycémique. Lorsque Byetta est ajouté à un traitement par metformine ou thiazolidinedione, la dose actuelle de metformine ou de thiazolidinedione peut être poursuivie car il est peu probable que la dose de metformine ou de thiazolidinedione nécessite un ajustement en raison d'une hypoglycémie lorsqu'elle est utilisée avec Byetta. Lorsque Byetta est ajouté à un traitement par sulfonylurée, une réduction de la dose de sulfonylurée peut être envisagée pour réduire le risque d'hypoglycémie (voir PRÉCAUTIONS, Hypoglycémie).
Byetta est un liquide clair et incolore et ne doit pas être utilisé si des particules apparaissent ou si la solution est trouble ou colorée. Byetta ne doit pas être utilisé après la date d'expiration. Aucune donnée n'est disponible sur l'innocuité ou l'efficacité de l'injection intraveineuse ou intramusculaire de Byetta.
Haut
Espace de rangement
Avant la première utilisation, Byetta doit être conservé au réfrigérateur entre 36 ° F et 46 ° F (2 ° C et 8 ° C). Après la première utilisation, Byetta peut être conservé à une température ne dépassant pas 77 ° F (25 ° C). Ne gèle pas. N'utilisez pas Byetta s'il a été congelé. Byetta doit être protégée de la lumière. Le stylo doit être jeté 30 jours après la première utilisation, même s'il reste du médicament dans le stylo.
Haut
Comment est fourni
Byetta est fourni sous forme de solution stérile pour injection sous-cutanée contenant 250 mcg / ml d'exénatide. Les packages suivants sont disponibles:
5 mcg par dose, 60 doses, stylo prérempli de 1,2 ml NDC 66780-210-07
10 mcg par dose, 60 doses, stylo prérempli de 2,4 ml NDC 66780-210-08
Rx UNIQUEMENT
Fabriqué pour Amylin Pharmaceuticals, Inc., San Diego, CA 92121
Commercialisé par Amylin Pharmaceuticals, Inc. et Eli Lilly and Company
1-800-868-1190
http://www.Byetta.com
Byetta est une marque déposée d'Amylin Pharmaceuticals, Inc.
© 2007 Amylin Pharmaceuticals, Inc. Tous les droits sont réservés.
dernière mise à jour 09/2007
Byetta (Exenatide) Information pour les patients (en anglais simple)
Informations détaillées sur les signes, les symptômes, les causes et les traitements du diabète
Les informations contenues dans cette monographie ne sont pas destinées à couvrir toutes les utilisations, directions, précautions, interactions médicamenteuses ou effets indésirables possibles. Ces informations sont généralisées et ne sont pas destinées à un avis médical spécifique. Si vous avez des questions sur les médicaments que vous prenez ou si vous souhaitez plus d'informations, consultez votre médecin, votre pharmacien ou votre infirmière.
retour à: Parcourir tous les médicaments pour le diabète



