Citrate de caféine: Stimulant (Information complète sur la prescription)
Nom de la marque: Cafcit
Nom générique: Citrate de caféine
Forme posologique: injection
Citrate de caféine est un stimulant du système nerveux central disponible sous forme de Cafcit, utilisé pour traiter l'apnée chez les bébés. Utilisation, posologie, effets secondaires.
Contenu:
La description
Pharmacologie clinique
Indications et usage
Avertissements
Précautions
Effets indésirables
Surdosage
Dosage et administration
Comment fournie
Caffeine citrate Information pour les patients (en anglais simple)
La description
L'injection de citrate de caféine pour administration intraveineuse et la solution orale de citrate de caféine sont claires, incolores, stériles, apyrogènes, solutions aqueuses sans conservateur ajustées à pH 4,7. Chaque mL contient 20 mg de citrate de caféine (équivalent à 10 mg de caféine base) préparé en en ajoutant 10 mg de caféine anhydre, USP à 5 mg d'acide citrique monohydraté, USP, 8,3 mg de citrate de sodium dihydraté, USP et eau pour Injection, USP.
La caféine, un stimulant du système nerveux central, est une poudre ou granule cristalline blanche inodore, au goût amer. Il est peu soluble dans l'eau et l'éthanol à température ambiante. Le nom chimique de la caféine est la 3,7-dihydro-1,3,7-triméthyl-1H-purine-2,6-dione. En présence d'acide citrique, il forme du sel de citrate de caféine en solution. La formule structurelle et le poids moléculaire du citrate de caféine suivent.
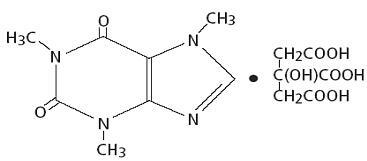
Citrate de caféine
C14H18N4O9 Mol. Wt. 386,31
Haut
Pharmacologie clinique
Mécanisme d'action
La caféine est structurellement liée à d'autres méthylxanthines, la théophylline et la théobromine. Il s'agit d'un relaxant des muscles lisses bronchiques, d'un stimulant du SNC, d'un stimulant du muscle cardiaque et d'un diurétique.
continuer l'histoire ci-dessous
Bien que le mécanisme d'action de la caféine dans l'apnée de la prématurité ne soit pas connu, plusieurs mécanismes ont été émis des hypothèses. Ceux-ci comprennent: (1) la stimulation du centre respiratoire, (2) une ventilation minute accrue, (3) une diminution du seuil d'hypercapnie, (4) une réponse accrue à l'hypercapnie, (5) augmentation du tonus musculaire squelettique, (6) diminution de la fatigue diaphragmatique, (7) augmentation du taux métabolique et (8) augmentation de l'oxygène consommation.
La plupart de ces effets ont été attribués à l'antagonisme des récepteurs de l'adénosine, sous-types A1 et A2, par la caféine, qui a été démontrée dans des essais de liaison aux récepteurs et observée à des concentrations proches de celles atteintes en thérapeutique.
Pharmacocinétique
Absorption: après administration orale de 10 mg de caféine base / kg à des nouveau-nés prématurés, le taux plasmatique maximal (Cmax) pour la caféine variait de 6 à 10 mg / L et le temps moyen pour atteindre la concentration maximale (Tmax) variait de 30 minutes à 2 heures. Le Tmax n'a pas été affectée par l'alimentation de formule. Cependant, la biodisponibilité absolue n'a pas été entièrement examinée chez les nouveau-nés prématurés.
Distribution: La caféine est rapidement distribuée dans le cerveau. Les niveaux de caféine dans le liquide céphalo-rachidien des nouveau-nés prématurés se rapprochent de leurs niveaux plasmatiques. Le volume moyen de distribution de la caféine chez les nourrissons (0,8-0,9 L / kg) est légèrement supérieur à celui des adultes (0,6 L / kg). Les données de liaison aux protéines plasmatiques ne sont pas disponibles pour les nouveau-nés ou les nourrissons. Chez l'adulte, la liaison moyenne aux protéines plasmatiques in vitro serait d'environ 36%.
Métabolisme: le cytochrome P450 1A2 hépatique (CYP1A2) est impliqué dans la biotransformation de la caféine. Le métabolisme de la caféine chez les nouveau-nés prématurés est limité en raison de leurs systèmes enzymatiques hépatiques immatures.
L'interconversion entre la caféine et la théophylline a été rapportée chez des nouveau-nés prématurés; les niveaux de caféine représentent environ 25% des niveaux de théophylline après l'administration de théophylline et environ 3 à 8% de la caféine administrée devraient se convertir en théophylline.
Élimination: Chez les jeunes nourrissons, l'élimination de la caféine est beaucoup plus lente que celle des adultes en raison de la fonction hépatique et / ou rénale immature. Demi-vie moyenne (T1/2) et la fraction excrétée inchangée dans l'urine (Ae) de la caféine chez les nourrissons se sont révélés être inversement liés à l'âge gestationnel / postconceptuel. Chez les nouveau-nés, le T1/2 est d'environ 3-4 jours et le Ae est d'environ 86% (dans les 6 jours). À l'âge de 9 mois, le métabolisme de la caféine se rapproche de celui observé chez l'adulte (T1/2 = 5 heures et Ae = 1%).
Populations particulières: Aucune étude portant sur la pharmacocinétique de la caféine chez les nouveau-nés atteints d'insuffisance hépatique ou rénale n'a été menée. Le citrate de caféine doit être administré avec prudence chez les nouveau-nés prématurés présentant une insuffisance rénale ou hépatique. Les concentrations sériques de caféine doivent être surveillées et l'administration de la dose de citrate de caféine doit être ajustée pour éviter la toxicité dans cette population.
Etudes cliniques
Un essai multicentrique, randomisé, en double aveugle a comparé le citrate de caféine au placebo chez quatre-vingt-cinq (85) nouveau-nés prématurés (âge gestationnel de 28 à <33 semaines) souffrant d'apnée de prématurité. L'apnée de prématurité a été définie comme ayant au moins 6 épisodes d'apnée d'une durée supérieure à 20 secondes sur une période de 24 heures sans autre cause identifiable d'apnée. Une dose de charge de 1 ml / kg (20 mg / kg de caféine fournissant 10 mg / kg de caféine base) de citrate de caféine a été administrée par voie intraveineuse, suivie d'une dose de 0,25 ml / kg (5 mg / kg de caféine citrate fournissant 2,5 mg / kg de caféine base) dose d'entretien quotidienne administrée par voie intraveineuse ou orale (généralement par une alimentation tube). La durée du traitement dans cette étude était limitée à 10 à 12 jours. Le protocole a permis aux nourrissons d'être «secourus» avec un traitement ouvert au citrate de caféine si leur apnée restait incontrôlée pendant la phase en double aveugle de l'essai.
Le pourcentage de patients sans apnée au jour 2 du traitement (24 à 48 heures après la dose de charge) était significativement plus élevé avec le citrate de caféine qu'avec le placebo. Le tableau suivant résume les critères d'évaluation cliniquement pertinents évalués dans cette étude: clip
| Citrate de caféine | Placebo | valeur p | |
|---|---|---|---|
| Nombre de patients évalués * | 45 | 37 | |
| % de patients avec zéro apnée au jour 2 | 26.7 | 8.1 | 0.03 |
| Taux d'apnée au jour 2 (par 24 heures) | 4.9 | 7.2 | 0.134 |
| % de patients avec une réduction de 50% des événements d'apnée par rapport au départ au jour 2 | 76 | 57 | 0.07 |
| * Sur 85 patients qui ont reçu le médicament, 3 n'ont pas été inclus dans l'analyse d'efficacité car ils avaient <6 épisodes d'apnée / 24 heures au départ. |
Dans cet essai de 10 à 12 jours, le nombre moyen de jours sans événement d'apnée était de 3 dans le groupe citrate de caféine et de 1,2 dans le groupe placebo. Le nombre moyen de jours avec une réduction de 50% par rapport aux valeurs initiales des événements d'apnée était de 6,8 dans le groupe citrate de caféine et de 4,6 dans le groupe placebo.
Haut
Indications et usage
L'injection de citrate de caféine et la solution buvable de citrate de caféine sont indiquées pour le traitement à court terme de l'apnée de la prématurité chez les nourrissons âgés de 28 à <33 semaines d'âge gestationnel.
Haut
Contre-indications
L'injection de citrate de caféine et la solution buvable de citrate de caféine sont contre-indiquées chez les patients qui ont démontré une hypersensibilité à l'un de ses composants.
Haut
Avertissements
Au cours de l'essai clinique en double aveugle contrôlé par placebo, 6 cas d'entérocolite nécrosante se sont développés parmi les 85 nourrissons étudiés (caféine = 46, placebo = 39), 3 cas ayant entraîné la mort. Cinq des six patients atteints d'entérocolite nécrosante ont été randomisés ou ont été exposés au citrate de caféine.
Des rapports dans la littérature publiée ont soulevé une question concernant l'association possible entre l'utilisation de méthylxanthines et développement d'entérocolite nécrosante, bien qu'une relation causale entre l'utilisation de méthylxanthine et l'entérocolite nécrosante n'ait pas été établi. Par conséquent, comme pour tous les nouveau-nés prématurés, les patients traités au citrate de caféine doivent être étroitement surveillés afin de détecter tout développement d'entérocolite nécrosante.
Haut
Précautions
Général
L'apnée de la prématurité est un diagnostic d'exclusion. Autres causes d'apnée (par exemple, troubles du système nerveux central, maladie pulmonaire primaire, anémie, septicémie, troubles métaboliques, anomalies cardiovasculaires, ou apnée obstructive) doivent être exclues ou correctement traitées avant l'initiation de la caféine Citrate.
La caféine est un stimulant du système nerveux central et en cas de surdosage en caféine, des convulsions ont été rapportées. Le citrate de caféine doit être utilisé avec prudence chez les nourrissons souffrant de troubles épileptiques.
La durée du traitement de l'apnée de la prématurité dans l'essai contrôlé par placebo a été limitée à 10 à 12 jours. L'innocuité et l'efficacité du citrate de caféine pendant de plus longues périodes de traitement n'ont pas été établies. Innocuité et efficacité du citrate de caféine pour une utilisation dans le traitement prophylactique de la mort subite du nourrisson (SIDS) ou avant l'extubation chez les nourrissons sous ventilation mécanique n'ont pas non plus été établi.
Cardiovasculaire
Bien qu'aucun cas de toxicité cardiaque n'ait été signalé dans l'essai contrôlé par placebo, il a été démontré que la caféine augmente la fréquence cardiaque, le débit ventriculaire gauche et le volume systolique dans les études publiées. Par conséquent, le citrate de caféine doit être utilisé avec prudence chez les nourrissons atteints de maladies cardiovasculaires.
Systèmes rénaux et hépatiques
Le citrate de caféine doit être administré avec prudence chez les nourrissons présentant une insuffisance rénale ou hépatique. Les concentrations sériques de caféine doivent être surveillées et l'administration de la dose de citrate de caféine doit être ajustée pour éviter la toxicité dans cette population. (Voir Pharmacologie clinique, Élimination, populations spéciales.)
Information pour les patients
Les parents / soignants des patients recevant une solution buvable de citrate de caféine devraient recevoir les instructions suivantes:
- La solution buvable de citrate de caféine ne contient aucun agent de conservation et chaque flacon est à usage unique. Toute portion inutilisée du médicament doit être jetée.
- Il est important que la dose de solution buvable de citrate de caféine soit mesurée avec précision, c'est-à-dire avec une 1 cc ou une autre seringue appropriée.
- Consultez votre médecin si le bébé continue d'avoir des apnées; n'augmentez pas la dose de solution buvable de citrate de caféine sans consultation médicale.
- Consultez votre médecin si le bébé commence à montrer des signes d'intolérance gastro-intestinale, comme une distension abdominale, des vomissements ou des selles sanglantes, ou semble léthargique.
- La solution buvable de citrate de caféine doit être inspectée visuellement à la recherche de particules et de décoloration avant son administration. Les flacons contenant une solution décolorée ou des particules visibles doivent être jetés.
Tests de laboratoire
Avant l'initiation du citrate de caféine, les taux sériques de base de caféine doivent être mesurés en les nourrissons précédemment traités par la théophylline, car les prématurés métabolisent la théophylline en caféine. De même, les niveaux sériques de base de caféine doivent être mesurés chez les nourrissons nés de mères qui ont consommé de la caféine avant l'accouchement, car la caféine traverse facilement le placenta.
Dans l'essai clinique contrôlé contre placebo, les niveaux de caféine variaient de 8 à 40 mg / L. Une plage thérapeutique de concentration plasmatique de caféine n'a pas pu être déterminée à partir de l'essai clinique contrôlé par placebo. Une toxicité grave a été rapportée dans la littérature lorsque les niveaux de caféine sérique dépassent 50 mg / L. Il peut être nécessaire de surveiller périodiquement les concentrations sériques de caféine tout au long du traitement pour éviter la toxicité.
Dans les études cliniques rapportées dans la littérature, des cas d'hypoglycémie et d'hyperglycémie ont été observés. Par conséquent, il peut être nécessaire de surveiller périodiquement la glycémie chez les nourrissons recevant du citrate de caféine.
Interactions médicamenteuses
Le cytochrome P450 1A2 (CYP1A2) est connu pour être la principale enzyme impliquée dans le métabolisme de la caféine. Par conséquent, la caféine a le potentiel d'interagir avec des médicaments qui sont des substrats du CYP1A2, inhibent le CYP1A2 ou induisent le CYP1A2.
Il existe peu de données sur les interactions médicamenteuses avec la caféine chez les nouveau-nés prématurés. D'après les données chez l'adulte, des doses plus faibles de caféine peuvent être nécessaires après la co-administration de médicaments qui diminueraient l'élimination de la caféine (par exemple, la cimétidine et le kétoconazole) et des doses plus élevées de caféine peuvent être nécessaires après la co-administration de médicaments qui augmentent l'élimination de la caféine (par exemple, le phénobarbital et la phénytoïne).
La caféine administrée en même temps que le kétoprofène a réduit le volume d'urine chez quatre volontaires sains. La signification clinique de cette interaction chez les nouveau-nés prématurés n'est pas connue.
L'interconversion entre la caféine et la théophylline a été rapportée chez des nouveau-nés prématurés. L'utilisation simultanée de ces médicaments n'est pas recommandée.
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de 2 ans sur des rats Sprague-Dawley, la caféine (sous forme de caféine base) administrée dans l'eau potable n'était pas cancérigène chez les rats mâles à des doses allant jusqu'à 102 mg / kg ou chez des rats femelles à des doses allant jusqu'à 170 mg / kg (environ 2 et 4 fois, respectivement, la dose de charge intraveineuse maximale recommandée pour les nourrissons mg / m2 base). Dans une étude de 18 mois chez des souris C57BL / 6, aucun signe de tumorigénicité n'a été observé à des doses alimentaires allant jusqu'à 55 mg / kg (moins que la dose de charge intraveineuse maximale recommandée pour les nourrissons à raison de mg / m2 base).
La caféine (sous forme de caféine base) a augmenté la métaphase SCE / cellule d'échange de chromatides sœurs (SCE) (en fonction du temps d'exposition) dans une analyse de métaphase de souris in vivo. La caféine a également potentialisé la génotoxicité des mutagènes connus et amélioré la formation de micronoyaux (5 fois) chez les souris déficientes en folates. Cependant, la caféine n'a pas augmenté les aberrations chromosomiques dans les tests in vitro de cellules ovariennes de hamster chinois (CHO) et de lymphocytes humains et a été non mutagène dans un test de mutation génique in vitro CHO / hypoxanthine guanine phosphoribosyltransférase (HGPRT), sauf cytotoxique concentrations. De plus, la caféine n'était pas clastogène dans un essai in vivo sur le micronoyau de souris.
Caféine (sous forme de caféine base) administrée à des rats mâles à 50 mg / kg / jour par voie sous-cutanée (approximativement égale à la dose de charge intraveineuse maximale recommandée pour les nourrissons en mg / m2 base) pendant 4 jours avant l'accouplement avec des femelles non traitées, a provoqué une diminution de la performance de reproduction des mâles en plus de provoquer une embryotoxicité. De plus, une exposition à long terme à des doses orales élevées de caféine (3 g sur 7 semaines) était toxique pour les testicules de rat, comme en témoigne la dégénérescence cellulaire spermatogénique.
Grossesse: catégorie de grossesse C
La préoccupation quant à la tératogénicité de la caféine n'est pas pertinente lorsqu'elle est administrée à des nourrissons. Dans des études réalisées chez des animaux adultes, la caféine (sous forme de caféine base) administrée à des souris gravides pastilles à libération prolongée à 50 mg / kg (inférieure à la dose de charge intraveineuse maximale recommandée pour les nourrissons sur un mg / m2 pendant la période d’organogenèse, a provoqué une faible incidence de fente palatine et d’exencéphalie chez les fœtus. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes.
Haut
Effets indésirables
Dans l'ensemble, le nombre d'événements indésirables signalés au cours de la période à double insu de l'essai contrôlé était similaire pour les groupes citrate de caféine et placebo. Le tableau suivant montre les événements indésirables survenus au cours de la période à double insu de l'essai contrôlé et qui étaient plus fréquents chez les patients traités par le citrate de caféine que le placebo.
| Événement indésirable (AE) | Citrate de caféine N = 46 n (%) |
Placebo N = 39 n (%) |
|---|---|---|
| CORPS ENTIER | ||
| Blessure accidentelle | 1 (2.2) | 0 (0.0) |
| Nourrir l'intolérance | 4 (8.7) | 2 (5.1) |
| État septique | 2 (4.3) | 0 (0.0) |
| SYSTÈME CARDIOVASCULAIRE | ||
| Hémorragie | 1 (2.2) | 0 (0.0) |
| SYSTÈME DIGESTIF | ||
| Entérocolite nécrosante | 2 (4.3) | 1 (2.6) |
| Gastrite | 1 (2.2) | 0 (0.0) |
| Hémorragie gastro-intestinale | 1 (2.2) | 0 (0.0) |
| SYSTÈME HÉMIQUE ET LYMPHATIQUE | ||
| Coagulation intravasculaire disséminée | 1 (2.2) | 0 (0.0) |
| TROUBLES MÉTABOLIQUES ET NUTRITIFS | ||
| Acidose | 1 (2.2) | 0 (0.0) |
| Guérison anormale | 1 (2.2) | 0 (0.0) |
| SYSTÈME NERVEUX | ||
| Hémorragie cérébrale | 1 (2.2) | 0 (0.0) |
| SYSTÈME RESPIRATOIRE | ||
| Dyspnée | 1 (2.2) | 0 (0.0) |
| Oedème pulmonaire | 1 (2.2) | 0 (0.0) |
| PEAU ET ANNEXES | ||
| Peau sèche | 1 (2.2) | 0 (0.0) |
| Éruption | 4 (8.7) | 3 (7.7) |
| Décomposition de la peau | 1 (2.2) | 0 (0.0) |
| SENS SPÉCIAUX | ||
| Rétinopathie de prématurité | 1 (2.2) | 0 (0.0) |
| SYSTÈME UROGÉNITAL | ||
| Insuffisance rénale | 1 (2.2) | 0 (0.0) |
En plus des cas ci-dessus, trois cas d'entérocolite nécrosante ont été diagnostiqués chez des patients recevant du citrate de caféine pendant la phase ouverte de l'étude.
Trois des nourrissons qui ont développé une entérocolite nécrosante au cours de l'essai sont décédés. Tous avaient été exposés à la caféine. Deux ont été randomisés pour la caféine, et un patient placebo a été «sauvé» avec de la caféine en ouvert pour l'apnée non contrôlée.
Les événements indésirables décrits dans la littérature publiée comprennent: stimulation du système nerveux central (c.-à-d. Irritabilité, agitation, nervosité), effets cardiovasculaires (c.-à-d. tachycardie, augmentation du débit ventriculaire gauche et augmentation du volume systolique), effets gastro-intestinaux (c.-à-d. augmentation de l'aspiration gastrique, intolérance gastro-intestinale), altérations de la glycémie (hypoglycémie et hyperglycémie) et des effets rénaux (augmentation du débit urinaire, augmentation de la clairance de la créatinine et augmentation du sodium et du calcium excrétion). Des études de suivi à long terme publiées n'ont pas montré que la caféine affecte négativement le développement neurologique ou les paramètres de croissance.
Haut
Surdosage
Après un surdosage, les taux sériques de caféine ont varié entre environ 24 mg / L (une rapport de cas spontané dans lequel un nourrisson présentait une irritabilité, une mauvaise alimentation et de l'insomnie) à 350 mg / L. Une toxicité grave a été associée à des taux sériques supérieurs à 50 mg / L (voir Précautions-Essais en laboratoire et Dosage et administration). Les signes et symptômes rapportés dans la littérature après un surdosage de caféine chez les nouveau-nés prématurés comprennent fièvre, tachypnée, nervosité, insomnie, tremblements fins des extrémités, hypertonie, opisthotonos, mouvements tonico-cloniques, mouvements non intentionnels de la mâchoire et des lèvres, vomissements, hyperglycémie, élévation de l'azote uréique sanguin et élévation des leucocytes totaux concentration. Des crises ont également été signalées en cas de surdosage. Un cas de surdosage en caféine compliqué par le développement d'une hémorragie intraventriculaire et de séquelles neurologiques à long terme a été rapporté. Un autre cas de surdosage de citrate de caféine (de Nouvelle-Zélande) d'environ 600 mg de citrate de caféine (environ 322 mg / kg) administré en 40 minutes a été compliqué par tachycardie, dépression ST, détresse respiratoire, insuffisance cardiaque, distension gastrique, acidose et une brûlure extravasation sévère avec nécrose tissulaire au niveau intraveineux périphérique site d'injection. Aucun décès associé à une surdose de caféine n'a été signalé chez les nouveau-nés prématurés.
Le traitement d'un surdosage de caféine est principalement symptomatique et favorable. Il a été démontré que les niveaux de caféine diminuent après les transfusions d'échange. Les convulsions peuvent être traitées par administration intraveineuse de diazépam ou d'un barbiturique tel que le pentobarbital sodique.
Haut
Dosage et administration
Avant l'initiation du citrate de caféine, les taux sériques de base de caféine doivent être mesurés en les nourrissons précédemment traités par la théophylline, car les prématurés métabolisent la théophylline en caféine. De même, les niveaux sériques de base de caféine doivent être mesurés chez les nourrissons nés de mères qui ont consommé de la caféine avant l'accouchement, car la caféine traverse facilement le placenta.
La dose de charge recommandée et les doses d'entretien de citrate de caféine suivent.
| Dose de caféine citrate Le volume |
Dose de caféine citrate mg / kg |
Route | La fréquence | |
|---|---|---|---|---|
| Dose de chargement | 1 ml / kg | 20 mg / kg | Intraveineux * (plus de 30 minutes) | Une fois |
| Dose d'entretien | 0,25 ml / kg | 5 mg / kg | Intraveineux * (plus de 10 minutes) ou par voie orale | Toutes les 24 heures ** |
| * à l'aide d'une pompe à perfusion à seringue ** à partir de 24 heures après la dose de charge |
NOTEZ QUE LA DOSE DE BASE DE CAFÉINE EST DE LA MOITIÉ DE LA DOSE UNE FOIS EXPRIMÉE COMME Citrate de Caféine (par exemple, 20 mg de Citrate de Caféine équivalent à 10 mg de caféine base).
Il peut être nécessaire de surveiller périodiquement les concentrations sériques de caféine tout au long du traitement pour éviter la toxicité. Une toxicité grave a été associée à des taux sériques supérieurs à 50 mg / L.
L'injection de citrate de caféine et la solution buvable de citrate de caféine doivent être inspectées visuellement pour détecter les particules et la décoloration avant l'administration. Les flacons contenant une solution décolorée ou des particules visibles doivent être jetés.
Compatibilité médicamenteuse
Pour tester la compatibilité des médicaments avec les solutions ou médicaments intraveineux courants, 20 ml d'injection de citrate de caféine ont été combiné avec 20 mL d'une solution ou d'un médicament, à l'exception d'un mélange Intralipid®, qui a été combiné en 80 mL / 80 mL. L'aspect physique des solutions combinées a été évalué pour la précipitation. Les mélanges ont été mélangés pendant 10 minutes puis testés pour la caféine. Les mélanges ont ensuite été mélangés en continu pendant 24 heures, avec un échantillonnage supplémentaire pour les dosages de caféine à 2, 4, 8 et 24 heures.
Sur la base de ces tests, l'injection de citrate de caféine, 60 mg / 3 ml est chimiquement stable pendant 24 heures à température ambiante lorsqu'elle est combinée avec les produits de test suivants.
- Injection de dextrose, USP 5%
- Injection de dextrose à 50% USP
- Intralipide® Emulsion IV à 20% de matières grasses
- Aminosyn® Solution d'acide aminé cristallin à 8,5%
- Dopamine HCI Injection, USP 40 mg / mL dilué à 0,6 mg / mL avec Dextrose Injection, USP 5%
- Injection de gluconate de calcium, USP 10% (0,465 mEq / Ca + 2 / mL)
- Injection d'héparine sodique, USP 1000 unités / ml diluée à 1 unité / ml avec injection de dextrose, USP 5%
- Injection de citrate de fentanyl, USP 50 µg / mL dilué à 10 µg / mL avec injection de dextrose, USP 5%
Haut
Comment fournie
L'injection de citrate de caféine et la solution orale de citrate de caféine sont disponibles sous forme de solutions aqueuses claires, incolores, stériles, apyrogènes, sans conservateur dans des flacons en verre incolore de 5 ml. Les flacons d'injection de citrate de caféine sont scellés avec un bouchon en caoutchouc gris et un joint en aluminium à rabat blanc imprimé avec "POUR USAGE INTRAVEINEUX UNIQUEMENT" en rouge. Les flacons de solution buvable de citrate de caféine sont scellés avec un bouchon en caoutchouc gris et un bleu foncé finition mate, rabattre le joint en aluminium détachable imprimé avec "POUR USAGE ORAL UNIQUEMENT - FLIP UP & TEAR" dans blanc.
Les flacons pour solution injectable et orale contiennent 3 ml de solution à une concentration de 20 mg / ml de citrate de caféine (60 mg / flacon) équivalent à 10 mg / ml de caféine base (30 mg / flacon).
Injection de citrate de caféine, USP
NDC 47335-289-40: flacon de 3 ml, emballé individuellement dans une boîte.
Solution buvable de citrate de caféine, USP
NDC 47335-290-44: flacon de 3 ml (NON RÉSISTANT À L'ENFANT), 10 flacons par blanc
récipient en polypropylène résistant aux enfants.
Conserver à 20 ° à 25 ° C (68 ° à 77 ° F); excursions permises entre 15 ° et 30 ° C (59 ° et 86 ° F) [voir USP Controlled Room Temperature].
Sans conservateur. Pour usage unique seulement. Jeter la portion inutilisée.
À L'ATTENTION DU PHARMACIEN: Détacher les "Instructions d'utilisation" de la notice et dispenser de la prescription de solution buvable de Citrate de Caféine.
Distribué par:
Caraco Pharmaceutical Laboratories, Ltd.
1150 Elijah McCoy Drive, Détroit, MI 48202
Fabriqué par:
Sun Pharmaceutical Ind. Ltd.
Autoroute Halol-Baroda,
Halol-389 350, Gujarat, Inde.
dernière mise à jour 02/2010
Caffeine citrate Information pour les patients (en anglais simple)
Informations détaillées sur Signes, symptômes, causes, traitements des troubles du sommeil
Les informations contenues dans cette monographie ne sont pas destinées à couvrir toutes les utilisations, directions, précautions, interactions médicamenteuses ou effets indésirables possibles. Ces informations sont généralisées et ne sont pas destinées à un avis médical spécifique. Si vous avez des questions sur les médicaments que vous prenez ou si vous souhaitez plus d'informations, consultez votre médecin, votre pharmacien ou votre infirmière.
retour à:
~ tous les articles sur les troubles du sommeil



