Iloperidone (fanapt) Information complète sur la prescription
Nom de marque: Fanapt
Nom générique: ilopéridone
Guide de prescription de Fanapt (ilopéridone) (PDF)
Contenu:
Avertissement encadré
Indications et usage
Dosage et administration
Contre-indications
Avertissements et precautions
Effets indésirables
Interactions médicamenteuses
Utilisation dans des populations spécifiques
Abus et dépendance aux drogues
Surdosage
La description
Pharmacologie clinique
Toxicologie non clinique
Etudes cliniques
Comment fournie
Guide de médication Brintellix
AVERTISSEMENT: AUGMENTATION DE LA MORTALITÉ CHEZ LES PATIENTS ÂGÉS ATTEINTS DE PSYCHOSE LIÉE À LA DÉMENCE
Les patients âgés atteints de psychose liée à la démence et traités avec des antipsychotiques présentent un risque accru de décès. FANAPT n'est pas approuvé pour le traitement des patients atteints de psychose liée à la démence.
Indications et usage
FANAPT® est indiqué pour le traitement de la schizophrénie chez l'adulte.
Lors de la décision parmi les traitements alternatifs disponibles pour cette condition, le prescripteur doit tenir compte de la conclusion selon laquelle FANAPT est associé à un allongement de l'intervalle QTc. La prolongation de l'intervalle QTc est associée dans certains autres médicaments à la capacité de provoquer une torsade de une arythmie de type pointes, une tachycardie ventriculaire polymorphe potentiellement mortelle qui peut décès. Dans de nombreux cas, cela conduirait à la conclusion que d'autres médicaments devraient être essayés en premier. On ne sait pas encore si FANAPT provoquera une torsade de pointes ou augmentera le taux de mort subite.
Les patients doivent être titrés à une dose efficace de FANAPT. Ainsi, le contrôle des symptômes peut être retardé au cours des 1 à 2 premières semaines de traitement par rapport à certains autres médicaments antipsychotiques qui ne nécessitent pas un titrage similaire. Les prescripteurs doivent être conscients de ce délai lorsqu'ils choisissent un médicament antipsychotique pour le traitement de la schizophrénie.
continuer l'histoire ci-dessous
Dosage et administration
Dose habituelle
FANAPT doit être titré lentement à partir d'une faible dose initiale pour éviter l'hypotension orthostatique en raison de ses propriétés de blocage alpha-adrénergique. La dose initiale recommandée pour les comprimés FANAPT est de 1 mg par voie orale deux fois par jour. Des augmentations de dose pour atteindre la plage cible de 6 à 12 mg deux fois par jour (12_24 mg / jour) peuvent être effectuées avec des ajustements posologiques quotidiens ne dépassant pas 2 mg deux fois par jour (4 mg / jour). La dose maximale recommandée est de 12 mg deux fois par jour (24 mg / jour). Les doses de FANAPT supérieures à 24 mg / jour n'ont pas été systématiquement évaluées dans les essais cliniques. L'efficacité a été démontrée avec FANAPT dans une plage de doses de 6 à 12 mg deux fois par jour. Les prescripteurs doivent être conscients du fait que les patients doivent être titrés à une dose efficace de FANAPT. Ainsi, le contrôle des symptômes peut être retardé au cours des 1 à 2 premières semaines de traitement par rapport à certains autres médicaments antipsychotiques qui ne nécessitent pas de titration similaire. Les prescripteurs doivent également savoir que certains effets indésirables associés à l'utilisation de FANAPT sont liés à la dose. FANAPT peut être administré sans égard aux repas.
Posologie dans des populations spéciales
Ajustement posologique pour les patients prenant FANAPT en association avec des inhibiteurs potentiels du CYP2D6: la dose de FANAPT doit être réduit de moitié lorsqu'il est administré en association avec de puissants inhibiteurs du CYP2D6 tels que la fluoxétine ou la paroxétine. Lorsque l'inhibiteur du CYP2D6 est retiré du traitement d'association, la dose de FANAPT doit alors être augmentée à son niveau antérieur.
Adaptation posologique pour les patients prenant FANAPT en association avec des inhibiteurs potentiels du CYP3A4: la dose de FANAPT doit être réduit de moitié lorsqu'il est administré en association avec des inhibiteurs puissants du CYP3A4 tels que le kétoconazole ou clarithromycine. Lorsque l'inhibiteur du CYP3A4 est retiré du traitement d'association, la dose de FANAPT doit être augmentée à son niveau antérieur.
Ajustement posologique pour les patients sous FANAPT qui sont de mauvais métaboliseurs du CYP2D6: la dose de FANAPT doit être réduite de moitié pour les métaboliseurs lents du CYP2D6.
Insuffisance hépatique: aucun ajustement posologique de FANAPT n'est nécessaire chez les patients présentant une insuffisance hépatique légère. Les patients présentant une insuffisance hépatique modérée peuvent nécessiter une réduction de la dose, si cela est cliniquement indiqué. FANAPT n'est pas recommandé chez les patients présentant une insuffisance hépatique sévère.
Traitement d'entretien
Dans une étude à plus long terme, FANAPT a été efficace pour retarder le temps de rechute chez les patients schizophrènes stabilisés sous FANAPT jusqu'à 24 mg / jour. Les patients doivent être périodiquement réévalués pour déterminer la nécessité d'un traitement d'entretien.
Réinitiation du traitement chez les patients précédemment arrêtés Bien qu’il n’existe pas de données permettant de traiter spécifiquement la traitement, il est recommandé de suivre le programme de titration d'initiation chaque fois que les patients ont eu un intervalle de plus de FANAPT moins de 3 jours.
Haut
Formes posologiques et forces
Les comprimés FANAPT sont disponibles dans les dosages suivants: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg et 12 mg. Les comprimés sont blancs, ronds, plats, à bords biseautés et identifiés par un logo «» gravé sur une face et la force du comprimé «1», «2», «4», «6», «8», «10», ou "12" en creux de l'autre côté.
Haut
Contre-indications
FANAPT est contre-indiqué chez les personnes présentant une réaction d'hypersensibilité connue au produit. Une anaphylaxie, un œdème de Quincke et d'autres réactions d'hypersensibilité ont été rapportées.
Haut
AVERTISSEMENTS ET PRECAUTIONS
Mortalité accrue chez les patients âgés atteints de psychose liée à la démence
Les médicaments antipsychotiques augmentent le risque de décès toutes causes confondues chez les patients âgés atteints de psychose liée à la démence. Analyses de 17 essais contrôlés versus placebo sur la psychose liée à la démence (durée modale de 10 semaines et principalement chez les patients prenant antipsychotiques) a révélé un risque de décès chez les patients traités par médicament de 1,6 à 1,7 fois supérieur à celui des patients sous placebo. Au cours d'un essai contrôlé typique de 10 semaines, le taux de décès chez les patients sous traitement médicamenteux était d'environ 4,5%, contre un taux d'environ 2,6% chez les patients sous placebo.
Bien que les causes de décès soient variées, la plupart des décès semblaient être de nature cardiovasculaire (par exemple, insuffisance cardiaque, mort subite) ou infectieuse (par exemple, pneumonie). FANAPT n'est pas approuvé pour le traitement des patients atteints de psychose liée à la démence.
Effets indésirables cérébrovasculaires, y compris un AVC, chez les patients âgés atteints de psychose liée à la démence
Dans les essais contrôlés contre placebo menés chez des sujets âgés atteints de démence, les patients randomisés sous rispéridone, l'aripiprazole et l'olanzapine avaient une incidence plus élevée d'AVC et d'attaque ischémique transitoire, y compris accident vasculaire cérébral. FANAPT n'est pas approuvé pour le traitement des patients atteints de psychose liée à la démence.
Prolongation de l'intervalle QT
Dans une étude ouverte sur le QTc chez des patients atteints de schizophrénie ou de trouble schizo-affectif (n = 160), FANAPT a été associé à une prolongation du QTc de 9 ms à une dose d'ilopéridone de 12 mg deux fois par jour. L'effet de FANAPT sur l'intervalle QT a été augmenté par la présence d'une inhibition métabolique du CYP450 2D6 ou 3A4 (paroxétine 20 mg une fois par jour et kétoconazole 200 mg deux fois par jour, respectivement). Dans des conditions d'inhibition métabolique pour 2D6 et 3A4, FANAPT 12 mg deux fois par jour a été associé à une augmentation moyenne du QTcF par rapport à la valeur initiale d'environ 19 msec.
Aucun cas de torsade de pointes ou d'autres arythmies cardiaques sévères n'a été observé pendant le programme clinique de pré-commercialisation.
L'utilisation de FANAPT doit être évitée en association avec d'autres médicaments connus pour prolonger le QTc, y compris la classe 1A (par exemple, quinidine, procaïnamide) ou classe III (par exemple, amiodarone, sotalol) médicaments antiarythmiques, médicaments antipsychotiques (par exemple, chlorpromazine, thioridazine), antibiotiques (par exemple, gatifloxacine, moxifloxacine), ou toute autre classe de médicaments connus pour prolonger l'intervalle QTc (par exemple, pentamidine, acétate de lévométhadyle, méthadone). FANAPT doit également être évité chez les patients atteints du syndrome du QT long congénital et chez les patients ayant des antécédents d'arythmies cardiaques.
Certaines circonstances peuvent augmenter le risque de torsade de pointes et / ou de mort subite en association avec l'utilisation de médicaments qui prolongent l'intervalle QTc, notamment (1) la bradycardie; (2) hypokaliémie ou hypomagnésémie; (3) l'utilisation concomitante d'autres médicaments qui prolongent l'intervalle QTc; et (4) présence d'un allongement congénital de l'intervalle QT; (5) infarctus aigu du myocarde récent; et / ou (6) insuffisance cardiaque non compensée.
La prudence s'impose lors de la prescription de FANAPT avec des médicaments qui inhibent le métabolisme de FANAPT, et chez les patients dont l'activité du CYP2D6 est réduite.
Il est recommandé que les patients envisagés pour un traitement par FANAPT qui présentent un risque de les perturbations électrolytiques ont des mesures de base de potassium et de magnésium sériques avec surveillance. L'hypokaliémie (et / ou l'hypomagnésémie) peut augmenter le risque d'allongement de l'intervalle QT et d'arythmie. FANAPT doit être évité chez les patients ayant des antécédents de maladie cardiovasculaire importante, par exemple QT prolongation, récent infarctus aigu du myocarde, insuffisance cardiaque non compensée ou arythmie cardiaque. FANAPT doit être arrêté chez les patients présentant des mesures de QTc persistantes> 500 msec.
Si les patients prenant FANAPT présentent des symptômes qui pourraient indiquer la survenue d'arythmies cardiaques, par exemple, étourdissements, palpitations ou syncope, le prescripteur doit entreprendre une évaluation plus approfondie, y compris cardiaque surveillance.
Syndrome malin des neuroleptiques (SMN)
Un complexe de symptômes potentiellement mortel parfois appelé syndrome malin des neuroleptiques (SMN) a été signalé en association avec l'administration d'antipsychotiques, y compris le FANAPT. Les manifestations cliniques comprennent l'hyperpyrexie, la rigidité musculaire, l'état mental altéré (y compris les signes catatoniques) et signes d'instabilité autonome (pouls ou pression artérielle irréguliers, tachycardie, diaphorèse et cardiaque dysrythmie). Des signes supplémentaires peuvent inclure une élévation de la créatine phosphokinase, une myoglobinurie (rhabdomyolyse) et une insuffisance rénale aiguë. L'évaluation diagnostique des patients atteints de ce syndrome est compliquée. Pour arriver à un diagnostic, il est important d'identifier les cas dans lesquels la présentation clinique comprend à la fois une maladie médicale grave et des signes et symptômes extrapyramidaux non traités ou insuffisamment traités (EPS). D'autres considérations importantes dans le diagnostic différentiel incluent la toxicité anticholinergique centrale, le coup de chaleur, la fièvre médicamenteuse et la pathologie du système nerveux central (SNC) primaire.
La prise en charge de ce syndrome doit inclure: (1) l'arrêt immédiat des antipsychotiques et autres médicaments non essentiels à la thérapie concomitante, (2) traitement symptomatique intensif et suivi médical, et (3) traitement de tout problème médical grave concomitant pour lequel des traitements spécifiques sont disponibles. Il n'y a pas d'accord général sur les schémas thérapeutiques spécifiques pour le SMN.
Si un patient nécessite un traitement médicamenteux antipsychotique après son rétablissement du SMN, la réintroduction potentielle d'un traitement médicamenteux doit être soigneusement envisagée. Le patient doit être surveillé attentivement, car des récidives de SMN ont été signalées.
Dyskinésie tardive
La dyskinésie tardive est un syndrome consistant en des mouvements dyskinétiques potentiellement irréversibles et involontaires, qui peuvent se développer chez les patients traités par des médicaments antipsychotiques. Bien que la prévalence du syndrome semble être la plus élevée chez les personnes âgées, en particulier les femmes âgées, il est impossible de s'appuyer sur des estimations de prévalence pour prédire, au début du traitement antipsychotique, quels patients sont susceptibles de syndrome. On ignore si les médicaments antipsychotiques diffèrent dans leur potentiel de provoquer une dyskinésie tardive.
On pense que le risque de développer une dyskinésie tardive et la probabilité qu'elle devienne irréversible augmenter en fonction de la durée du traitement et de la dose cumulée totale d'antipsychotiques administrés augmente. Cependant, le syndrome peut se développer, bien que beaucoup moins fréquemment, après des périodes de traitement relativement brèves à faibles doses.
Il n'y a pas de traitement connu pour les cas établis de dyskinésie tardive, bien que le syndrome puisse disparaître, partiellement ou complètement, si le traitement antipsychotique est arrêté. Cependant, le traitement antipsychotique lui-même peut supprimer (ou supprimer partiellement) les signes et symptômes du syndrome et peut ainsi masquer le processus sous-jacent. L'effet que la suppression symptomatique a sur l'évolution à long terme du syndrome est inconnu.
Compte tenu de ces considérations, FANAPT doit être prescrit de la manière la plus susceptible de minimiser l'apparition d'une dyskinésie tardive. Le traitement antipsychotique chronique doit généralement être réservé aux patients qui souffrent d'une maladie chronique (1) connue pour antipsychotiques, et (2) pour lesquels aucun traitement alternatif, tout aussi efficace mais potentiellement moins nocif n'est disponible ou approprié. Chez les patients qui nécessitent un traitement chronique, la plus petite dose et la durée de traitement la plus courte produisant une réponse clinique satisfaisante doivent être recherchées. La nécessité de poursuivre le traitement doit être réévaluée périodiquement.
Si des signes et symptômes de dyskinésie tardive apparaissent chez un patient sous FANAPT, l'arrêt du médicament doit être envisagé. Cependant, certains patients peuvent nécessiter un traitement par FANAPT malgré la présence du syndrome.
Changements métaboliques
Les antipsychotiques atypiques ont été associés à des changements métaboliques susceptibles d'augmenter le risque cardiovasculaire / cérébrovasculaire. Ces changements métaboliques comprennent l'hyperglycémie, la dyslipidémie et la prise de poids corporel. Bien qu'il ait été démontré que tous les antipsychotiques atypiques produisent certains changements métaboliques, chaque médicament de la classe a son propre profil de risque spécifique.
Hyperglycémie et diabète sucré
Une hyperglycémie, dans certains cas extrême et associée à une acidocétose ou un coma hyperosmolaire ou à la mort, a été rapportée chez des patients traités par des antipsychotiques atypiques, y compris FANAPT. L'évaluation de la relation entre l'utilisation d'antipsychotiques atypiques et les anomalies du glucose est compliquée par la possibilité d'une augmentation risque de fond de diabète sucré chez les patients atteints de schizophrénie et l'incidence croissante du diabète sucré en général population. Compte tenu de ces facteurs de confusion, la relation entre l'utilisation d'antipsychotiques atypiques et les événements indésirables liés à l'hyperglycémie n'est pas complètement comprise. Cependant, les études épidémiologiques suggèrent un risque accru d'événements indésirables liés à l'hyperglycémie chez les patients traités avec les antipsychotiques atypiques inclus dans ces études.
Les patients dont le diagnostic de diabète sucré est établi et qui commencent un traitement antipsychotique atypique doivent être surveillés régulièrement afin de détecter une aggravation du contrôle glycémique. Patients présentant des facteurs de risque de diabète sucré (par exemple, obésité, antécédents familiaux de diabète) qui commencent un traitement par les antipsychotiques atypiques doivent subir un test de glycémie à jeun au début du traitement et périodiquement pendant traitement. Tout patient traité avec des antipsychotiques atypiques doit être surveillé pour détecter les symptômes d'hyperglycémie, notamment la polydipsie, la polyurie, la polyphagie et la faiblesse. Les patients qui développent des symptômes d'hyperglycémie pendant le traitement avec des antipsychotiques atypiques doivent subir un test de glycémie à jeun. Dans certains cas, l'hyperglycémie s'est résorbée lors de l'arrêt de l'antipsychotique atypique; cependant, certains patients ont dû poursuivre le traitement antidiabétique malgré l'arrêt du médicament suspect.
Les données d'une étude à dose fixe de 4 semaines chez des sujets adultes atteints de schizophrénie, dans laquelle des échantillons de sang à jeun ont été prélevés, sont présentées dans le tableau 1.
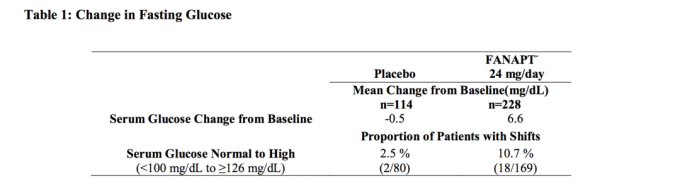
Des analyses groupées des données sur le glucose provenant d'études cliniques, y compris des essais à plus long terme, sont présentées dans le tableau 2.
Dyslipidémie
Des altérations indésirables des lipides ont été observées chez des patients traités par des antipsychotiques atypiques.
Le tableau 3 présente des données provenant d'une étude à dose fixe de 4 semaines contrôlée contre placebo, dans laquelle des échantillons de sang à jeun ont été prélevés chez des sujets adultes atteints de schizophrénie.

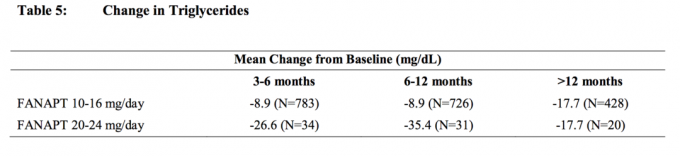
Des analyses groupées des données sur le cholestérol et les triglycérides provenant d'études cliniques, y compris des essais à plus long terme, sont présentées dans les tableaux 4 et 5.

Gain de poids
Une prise de poids a été observée avec l'utilisation d'antipsychotiques atypiques. Une surveillance clinique du poids est recommandée.
Dans toutes les études à court et à long terme, la variation moyenne globale par rapport au départ au point final était de 2,1 kg.
Changements dans le poids corporel (kg) et la proportion de sujets avec ≥7% de gain de poids corporel de 4 Des études contrôlées contre placebo, à doses fixes ou flexibles de 4 ou 6 semaines chez des sujets adultes sont présentées dans Tableau 6.

Saisies
Dans les essais contrôlés par placebo à court terme (4 à 6 semaines), des convulsions ont été observées chez 0,1% (1/1344) des patients traités par FANAPT contre 0,3% (2/587) sous placebo. Comme avec d'autres antipsychotiques, FANAPT doit être utilisé avec prudence chez les patients ayant des antécédents de convulsions ou présentant des conditions susceptibles d'abaisser le seuil de convulsions. Les conditions qui abaissent le seuil de saisie peuvent être plus fréquentes dans une population de 65 ans ou plus.
Hypotension orthostatique et syncope
FANAPT peut induire une hypotension orthostatique associée à des étourdissements, une tachycardie et une syncope. Cela reflète ses propriétés antagonistes alpha1-adrénergiques. Dans les études à court terme contrôlées contre placebo en double aveugle, où la dose a été augmentée lentement, comme recommandé ci-dessus, une syncope a été rapportée chez 0,4% (5/1344) des patients traités par FANAPT, contre 0,2% (1/587) le placebo. Une hypotension orthostatique a été rapportée chez 5% des patients ayant reçu 20 à 24 mg / jour, 3% des patients ayant reçu 10 à 16 mg / jour et 1% des patients ayant reçu un placebo. Un titrage plus rapide devrait augmenter le taux d'hypotension orthostatique et de syncope.
FANAPT doit être utilisé avec prudence chez les patients présentant une maladie cardiovasculaire connue (par exemple, insuffisance cardiaque, antécédents d'infarctus du myocarde, ischémie ou conduction). anormales), une maladie cérébrovasculaire ou des conditions qui prédisposent le patient à l'hypotension (déshydratation, hypovolémie et traitement par antihypertenseur). médicaments). La surveillance des signes vitaux orthostatiques doit être envisagée chez les patients vulnérables à l'hypotension.
Leucopénie, neutropénie et agranulocytose
Dans les essais cliniques et l'expérience post-commercialisation, des événements de leucopénie / neutropénie ont été rapportés dans le temps en relation avec des antipsychotiques. Une agranulocytose (y compris des cas mortels) a également été signalée.
Les facteurs de risque possibles de leucopénie / neutropénie comprennent un faible nombre de globules blancs (WBC) préexistant et des antécédents de leucopénie / neutropénie induite par le médicament. Les patients présentant un faible taux de globules blancs préexistants ou des antécédents de leucopénie / neutropénie induite par un médicament doivent faire surveiller leur hémogramme complet (CBC) fréquemment au cours des premiers mois de traitement et devrait arrêter FANAPT au premier signe d'une baisse du WBC en l'absence d'autres causes facteurs.
Les patients atteints de neutropénie doivent être étroitement surveillés pour détecter de la fièvre ou d'autres symptômes ou signes d'infection et être traités rapidement si de tels symptômes ou signes se produisent. Les patients atteints de neutropénie sévère (nombre absolu de neutrophiles <1000 / mm3) doivent arrêter FANAPT et faire suivre leur WBC jusqu'à la récupération.
Hyperprolactinémie
Comme avec d'autres médicaments qui antagonisent les récepteurs de la dopamine D2, FANAPT élève les niveaux de prolactine.
L'hyperprolactinémie peut supprimer la GnRH hypothalamique, entraînant une diminution de la sécrétion de gonadotrophine hypophysaire. Ceci, à son tour, peut inhiber la fonction de reproduction en altérant la gonadalstéroïdogenèse chez les femmes et les hommes. La galactorrhée, l'aménorrhée, la gynécomastie et l'impuissance ont été rapportées avec des composés augmentant la prolactine. Une hyperprolactinémie de longue date, associée à un hypogonadisme, peut entraîner une diminution de la densité osseuse chez les femmes et les hommes.
Des expériences de culture de tissus indiquent qu’environ un tiers des cancers du sein chez l’homme dépendent de la prolactine in vitro, un facteur d'importance potentielle si la prescription de ces médicaments est envisagée chez une patiente dont le sein a déjà été détecté cancer. Des changements prolifératifs des glandes mammaires et des augmentations de la prolactine sérique ont été observés chez des souris et des rats traités par FANAPT. Ni les études cliniques ni les études épidémiologiques menées à ce jour n'ont montré d'association entre l'administration chronique de cette classe de médicaments et la tumorigenèse chez l'homme; les preuves disponibles sont jugées trop limitées pour être concluantes à l'heure actuelle.
Dans un essai contrôlé par placebo à court terme (4 semaines), la variation moyenne des concentrations plasmatiques de prolactine par rapport aux valeurs initiales pour le groupe traité par FANAPT à 24 mg / jour était une augmentation de 2,6 ng / mL par rapport à une diminution de 6,3 ng / mL groupe placebo. Dans cet essai, des taux plasmatiques élevés de prolactine ont été observés chez 26% des adultes traités par FANAPT contre 12% dans le groupe placebo. Dans les essais à court terme, FANAPT a été associé à des niveaux modestes d'élévation de la prolactine par rapport à des élévations de prolactine plus importantes observées avec certains autres agents antipsychotiques. Dans une analyse groupée d'études cliniques incluant des essais à plus long terme, chez 3 210 adultes traités par ilopéridone, une gynécomastie a été rapportée chez 2 sujets masculins (0,1%) contre 0% chez les patients sous placebo, et une galactorrhée a été rapportée chez 8 femmes (0,2%) contre 3 femmes (0,5%) chez les patients sous placebo. les patients.
Régulation de la température corporelle
La perturbation de la capacité du corps à réduire la température corporelle centrale a été attribuée aux agents antipsychotiques. Des soins appropriés sont conseillés lors de la prescription de FANAPT aux patients qui connaîtront des conditions qui peuvent contribuer à une élévation du corps central température, par exemple, faire de l'exercice, une exposition à une chaleur extrême, recevoir des médicaments concomitants ayant une activité anticholinergique ou être soumis à déshydratation.
Dysphagie
La dysmotilité œsophagienne et l'aspiration ont été associées à l'utilisation d'antipsychotiques. La pneumonie par aspiration est une cause fréquente de morbidité et de mortalité chez les patients âgés. FANAPT et d'autres antipsychotiques doivent être utilisés avec prudence chez les patients à risque de pneumonie par aspiration.
Suicide
La possibilité d'une tentative de suicide est inhérente à la maladie psychotique, et une surveillance étroite des patients à haut risque doit accompagner le traitement médicamenteux. Les prescriptions de FANAPT doivent être rédigées pour la plus petite quantité de comprimés compatible avec une bonne gestion des patients afin de réduire le risque de surdosage.
Priapisme
Trois cas de priapisme ont été signalés dans le programme de pré-commercialisation FANAPT. Il a été rapporté que des médicaments ayant des effets de blocage alpha-adrénergiques induisent un priapisme. FANAPT partage cette activité pharmacologique. Un priapisme sévère peut nécessiter une intervention chirurgicale.
Potentiel de déficience cognitive et motrice
FANAPT, comme d'autres antipsychotiques, peut altérer le jugement, la pensée ou les capacités motrices. Dans les essais à court terme contrôlés contre placebo, une somnolence (y compris la sédation) a été rapportée dans 11,9% (104/874) des cas. patients adultes traités par FANAPT à des doses de 10 mg / jour ou plus contre 5,3% (31/587) traités par placebo. Les patients doivent être avertis de l'utilisation de machines dangereuses, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement certains que le traitement par FANAPT ne les affecte pas négativement.
Haut
Effets indésirables
Expérience en études cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans l'essai clinique d'un médicament ne peut être directement comparé aux taux dans les essais cliniques d'un autre médicament et peut ne pas refléter les taux observés en clinique entraine toi. Les informations ci-dessous sont dérivées d'une base de données d'essais cliniques pour FANAPT comprenant 3229 patients exposés à FANAPT à des doses de 10 mg / jour ou plus, pour le traitement de la schizophrénie. Parmi ceux-ci, 999 ont reçu FANAPT pendant au moins 6 mois, et 657 ont été exposés à FANAPT pendant au moins 12 mois. Tous ces patients qui ont reçu FANAPT participaient à des essais cliniques à doses multiples. Les conditions et la durée du traitement par FANAPT variaient considérablement et incluaient (dans les catégories qui se chevauchaient), phases d'études en double aveugle, patients hospitalisés et ambulatoires, études à dose fixe et à dose flexible, et à court terme et à plus long terme exposition.
Les informations présentées dans ces sections ont été dérivées de données regroupées provenant de 4 groupes contrôlés contre placebo, de 4 ou 6 semaines, études à doses fixes ou flexibles chez des patients ayant reçu FANAPT à des doses quotidiennes comprises entre 10 et 24 mg (n = 874).
Effets indésirables survenus à une incidence de 2% ou plus chez les patients traités par FANAPT et plus fréquents que le placebo
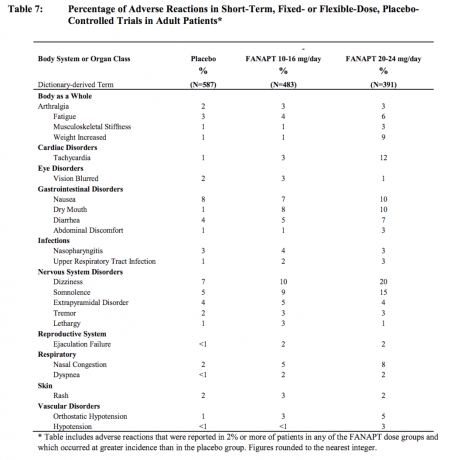
Le tableau 7 énumère les incidences groupées des effets indésirables qui ont été spontanément signalés dans quatre semaines contrôlées contre placebo, 4 ou 6 semaines, études à doses fixes ou flexibles, répertoriant les réactions survenues chez 2% ou plus des patients traités par FANAPT à n'importe quelle dose et pour lesquels l'incidence chez les patients traités par FANAPT dans n'importe quel groupe de dose était supérieure à l'incidence chez les patients traités par placebo.
Effets indésirables liés à la dose dans les essais cliniques
Sur la base des données regroupées issues de 4 études contrôlées versus placebo, à doses fixes ou flexibles de 4 ou 6 semaines, effets indésirables survenus avec plus de 2% chez les patients traités par FANAPT, et pour lesquels l'incidence chez les patients traités par FANAPT 20-24 mg / jour était deux fois supérieure à les patients traités par FANAPT 10 -16 mg / jour étaient: gêne abdominale, étourdissements, hypotension, rigidité musculo-squelettique, tachycardie et poids augmenté.
Effets indésirables courants et liés au médicament dans les essais cliniques
Sur la base des données regroupées de 4 études contrôlées versus placebo, à doses fixes ou flexibles de 4 ou 6 semaines, les effets indésirables suivants sont survenus dans une incidence ≥5% chez les patients traités avec FANAPT et au moins deux fois le rat placebo e pour au moins 1 dose: étourdissements, bouche sèche, fatigue, congestion nasale, somnolence, tachycardie, hypotension orthostatique et poids augmenté. Les étourdissements, la tachycardie et l'augmentation de poids étaient au moins deux fois plus fréquents à 20-24 mg / jour qu'à 10-16 mg / jour.
Symptômes extrapyramidaux (EPS) dans les essais cliniques
Les données regroupées des 4 études contrôlées contre placebo, à doses fixes ou flexibles de 4 ou 6 semaines, ont fourni des informations concernant l'EPS. Les données sur les événements indésirables recueillies à partir de ces essais ont montré les taux suivants d'événements indésirables liés à l'EPS, comme indiqué dans le tableau 8.
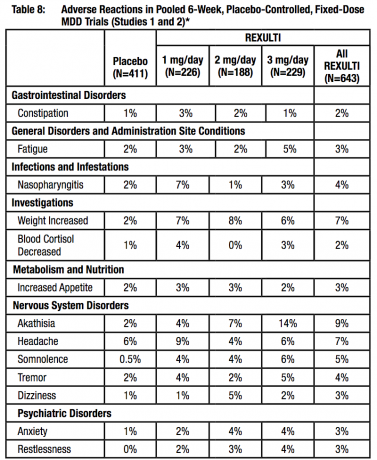
Effets indésirables associés à l'arrêt du traitement dans les essais cliniques
Sur la base des données regroupées de 4 études contrôlées versus placebo, à doses fixes ou flexibles de 4 ou 6 semaines, aucune différence dans l'incidence des arrêts de traitement en raison d'événements indésirables entre les patients traités par FANAPT (5%) et les patients sous placebo (5%) les patients. Les types d'événements indésirables qui ont conduit à l'arrêt du traitement étaient similaires pour les patients traités par FANAPT et par placebo.
Différences démographiques dans les effets indésirables des essais cliniques
Un examen des sous-groupes de population dans les 4 groupes contrôlés contre placebo, à 4 ou 6 semaines, à les études à doses flexibles n'ont révélé aucune preuve de différences de sécurité en fonction de l'âge, sexe ou race.
Anomalies des tests de laboratoire dans les essais cliniques
Il n'y avait aucune différence entre FANAPT et le placebo dans l'incidence de l'arrêt en raison de changements dans l'hématologie, l'analyse d'urine ou la chimie sérique.
Dans les essais contrôlés par placebo à court terme (de 4 à 6 semaines), 1,0% (13/1342) des patients traités par ilopéridone hématocrite au moins une fois en dessous de la plage normale étendue pendant le traitement post-randomisation, contre 0,3% (2/585) le placebo. La plage normale étendue d'hématocrite abaissé a été définie dans chacun de ces essais comme étant la valeur 15% inférieure à la plage normale pour le laboratoire centralisé utilisé dans l'essai.
Autres réactions lors de l'évaluation préalable à la commercialisation de FANAPT
Ce qui suit est une liste de termes MedDRA qui reflètent les effets indésirables chez les patients traités par FANAPT à plusieurs doses ≥ 4 mg / jour pendant n'importe quelle phase d'un essai avec la base de données de 3210 traités par FANAPT les patients. Toutes les réactions signalées sont incluses à l'exception de celles déjà répertoriées dans le tableau 7, ou d'autres parties des effets indésirables (6), celles considérées dans le Avertissements et précautions (5), ces termes de réaction qui étaient si généraux qu’ils n’étaient pas informatifs, réactions rapportées chez moins de 3 patients et qui n'étaient ni graves ni mettant en jeu le pronostic vital, des réactions qui sont par ailleurs courantes comme réactions de fond et des réactions considérées comme peu susceptibles d'être des en relation.
Les réactions sont en outre classées par classe de système d'organes MedDRA et répertoriées par ordre décroissant de fréquence selon les éléments suivants définitions: les événements indésirables fréquents sont ceux survenus chez au moins 1/100 patients (seuls ceux qui ne figurent pas dans le tableau 7 référencement); les effets indésirables peu fréquents sont ceux survenus chez 1/100 à 1/1000 patients; les événements rares sont ceux survenus chez moins de 1/1 000 patients.
Troubles sanguins et lymphatiques: Peu fréquents - anémie, anémie ferriprive; Rare – leucopénie
Troubles cardiaques: fréquents - palpitations; Rare - arythmie, bloc auriculo-ventriculaire de premier degré, insuffisance cardiaque (y compris congestive et aiguë)
Troubles de l'oreille et du labyrinthe: Peu fréquents - vertige, acouphènes
Troubles endocriniens: peu fréquents - hypothyroïdie
Troubles oculaires: Fréquents - conjonctivite (y compris allergique); Peu fréquent - sécheresse oculaire, blépharite, œdème des paupières, gonflement des yeux, opacités lenticulaires, cataracte, hyperémie (y compris conjonctivale)
Troubles gastro-intestinaux: Peu fréquents - gastrite, hypersécrétion salivaire, incontinence fécale, ulcération de la bouche; Rare - stomatite aphteuse, ulcère duodénal, hernie hiatale, hyperchlorhydrie, ulcération des lèvres, œsophagite par reflux, stomatite
Troubles généraux et anomalies au site administratif: Peu fréquents - œdème (général, piqûres, dû à une maladie cardiaque), difficulté à marcher, soif; Rare - hyperthermie
Troubles hépatobiliaires: peu fréquents - cholélithiase
Enquêtes: Fréquentes: perte de poids; Peu fréquents - diminution de l'hémoglobine, augmentation du nombre de neutrophiles, diminution de l'hématocrite
Troubles du métabolisme et de la nutrition: peu fréquents - augmentation de l'appétit, déshydratation, hypokaliémie, rétention d'eau
Troubles musculo-squelettiques et du tissu conjonctif: Fréquents - myalgie, spasmes musculaires; Rare - torticolis
Troubles du système nerveux: paresthésie peu fréquente, hyperactivité psychomotrice, agitation, amnésie, nystagmus; Rare - syndrome des jambes sans repos
Troubles psychiatriques: Fréquents - agitation, agression, délire; Peu fréquents - hostilité, diminution de la libido, paranoïa, anorgasmie, état confusionnel, manie, catatonie, sautes d'humeur, panique attaque, trouble obsessionnel-compulsif, boulimie nerveuse, délire, polydipsie psychogène, trouble du contrôle des impulsions, majeur la dépression
Troubles rénaux et urinaires: Fréquent - incontinence urinaire; Peu fréquents - dysurie, pollakiurie, énurésie, néphrolithiase; Rare - rétention urinaire, insuffisance rénale aiguë
Système reproducteur et troubles mammaires: Fréquent - dysfonction érectile; Infrequen - douleur testiculaire, aménorrhée, douleur mammaire; Rare - menstruations irrégulières, gynécomastie, ménorragie, métrorragie, hémorragie postménopausique, prostatite.
Troubles respiratoires, thoraciques et médiastinaux: peu fréquents - épistaxis, asthme, rhinorrhée, congestion des sinus, sécheresse nasale; Rare - sécheresse de la gorge, syndrome d'apnée du sommeil, dyspnée d'effort
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de FANAPT: éjaculation rétrograde et réactions d'hypersensibilité (y compris anaphylaxie; angioedème; oppression de la gorge; gonflement oropharyngé; gonflement du visage, des lèvres, de la bouche et de la langue; urticaire; éruption; et prurit). Étant donné que ces réactions ont été signalées volontairement par une population de taille incertaine, il n'est pas possible d'estimer de manière fiable leur fréquence ou d'établir une relation de cause à effet avec l'exposition au médicament.
Haut
Interactions médicamenteuses
Compte tenu des principaux effets sur le système nerveux central de FANAPT, il convient d'être prudent lorsqu'il est pris en association avec d'autres médicaments à action centrale et de l'alcool. En raison de son antagonisme des récepteurs alpha1-adrénergiques, FANAPT a le potentiel d'améliorer l'effet de certains agents antihypertenseurs.
Potentiel pour d'autres médicaments d'affecter FANAPT
L'ilopéridone n'est pas un substrat pour les enzymes CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ou CYP2E1. Cela suggère qu'une interaction de l'ilopéridone avec des inhibiteurs ou des inducteurs de ces enzymes, ou d'autres facteurs, comme le tabagisme, est peu probable. Le CYP3A4 et le CYP2D6 sont tous deux responsables du métabolisme de l'ilopéridone. Les inhibiteurs du CYP3A4 (par exemple, le kétoconazole) ou du CYP2D6 (par exemple, la fluoxétine, la paroxétine) peuvent inhiber l'élimination de l'ilopéridone et provoquer une augmentation des taux sanguins.
Kétoconazole: Co-administration de kétoconazole (200 mg deux fois par jour pendant 4 jours), un puissant inhibiteur du CYP3A4, avec une dose unique de 3 mg d'ilopéridone à 19 des volontaires sains, âgés de 18 à 45 ans, ont augmenté la surface sous la courbe (ASC) de l'ilopéridone et de ses métabolites P88 et P95 de 57%, 55% et 35%, respectivement. Les doses d'ilopéridone doivent être réduites d'environ la moitié lorsqu'elles sont administrées avec du kétoconazole ou d'autres inhibiteurs puissants du CYP3A4 (par exemple, l'itraconazole). Les inhibiteurs plus faibles (par exemple, l'érythromycine, le jus de pamplemousse) n'ont pas été étudiés. Lorsque l'inhibiteur du CYP3A4 est retiré du traitement d'association, la dose d'ilopéridone doit être ramenée au niveau précédent.
Fluoxétine: co-administration de fluoxétine (20 mg deux fois par jour pendant 21 jours), un puissant inhibiteur du CYP2D6, avec une dose unique de 3 mg d'ilopéridone à 23 volontaires sains, âgés de 29 à 44 ans, classés métaboliseurs extensifs du CYP2D6, augmentait l'ASC de l'ilopéridone et de son métabolite P88 d'environ 2 à 3 fois et diminuait l'ASC de son métabolite P95 de une moitié. Les doses d'ilopéridone doivent être réduites de moitié lorsqu'elles sont administrées avec de la fluoxétine. Lorsque la fluoxétine est retirée du traitement d'association, la dose d'ilopéridone doit être ramenée au niveau précédent. D'autres inhibiteurs puissants du CYP2D6 devraient avoir des effets similaires et nécessiteraient des réductions de dose appropriées. Lorsque l'inhibiteur du CYP2D6 est retiré du traitement d'association, la dose d'ilopéridone peut alors être augmentée au niveau précédent.
Paroxétine: co-administration de paroxétine (20 mg / jour pendant 5-8 jours), un puissant inhibiteur du CYP2D6, avec plusieurs doses d'ilopéridone (8 ou 12 mg deux fois par jour) chez les patients schizophrènes âgés de 18 à 65 ans a entraîné une augmentation des concentrations moyennes l'ilopéridone et son métabolite P88, d'environ 1,6 fois, et une diminution des concentrations moyennes maximales à l'état d'équilibre de son métabolite P95 de une moitié. Les doses d'ilopéridone doivent être réduites de moitié lorsqu'elles sont administrées avec de la paroxétine. Lorsque la paroxétine est retirée du traitement d'association, la dose d'ilopéridone doit être ramenée au niveau précédent. D'autres inhibiteurs puissants du CYP2D6 devraient avoir des effets similaires et nécessiteraient des réductions de dose appropriées. Lorsque l'inhibiteur du CYP2D6 est retiré du traitement d'association, la dose d'ilopéridone peut alors être augmentée aux niveaux précédents.
Paroxétine et kétoconazole: co-administration de paroxétine (20 mg une fois par jour pendant 10 jours), d'un inhibiteur du CYP2D6 et de kétoconazole (200 mg deux fois par jour) avec des doses multiples d'ilopéridone (8 ou 12 mg deux fois par jour) à des patients schizophrènes âgés de 18 à 65 ans augmentation des concentrations à l'état d'équilibre de l'ilopéridone et de son métabolite P88 et diminution de 1,4 fois du P95 en présence de la paroxétine. L'administration d'ilopéridone avec des inhibiteurs de ses deux voies métaboliques n'a donc pas ajouté à l'effet de l'un ou l'autre inhibiteur administré seul. Les doses d'ilopéridone doivent donc être réduites d'environ la moitié en cas d'administration concomitante avec un inhibiteur du CYP2D6 et du CYP3A4.
Potentiel pour FANAPT d'affecter d'autres médicaments
Des études in vitro sur des microsomes hépatiques humains ont montré que l'ilopéridone n'inhibe pas sensiblement le métabolisme des médicaments métabolisés par les isozymes du cytochrome P450 suivants: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 ou CYP2E1. De plus, des études in vitro sur des microsomes hépatiques humains ont montré que l'ilopéridone ne possède pas d'induction enzymatique. propriétés spécifiques des isoenzymes du cytochrome P450 suivantes: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 et CYP3A5.
Dextrométhorphane: une étude menée chez des volontaires sains a montré que des modifications de la pharmacocinétique du dextrométhorphane (dose de 80 mg) lorsqu'une dose de 3 mg de l'ilopéridone a été co-administré, ce qui a entraîné une augmentation de 17% de l'exposition totale et une augmentation de 26% des concentrations plasmatiques maximales C max de dextrométhorphane. Ainsi, une interaction entre l'ilopéridone et d'autres substrats du CYP2D6 est peu probable.
Fluoxétine: une dose unique de 3 mg d'ilopéridone n'a eu aucun effet sur la pharmacocinétique de la fluoxétine (20 mg deux fois par jour).
Midazolam (un substrat sensible du CYP 3A4): une étude chez des patients atteints de schizophrénie a montré une augmentation de moins de 50% du total de midazolam exposition à l'état d'équilibre de l'ilopéridone (14 jours de prise orale jusqu'à 10 mg d'ilopéridone deux fois par jour) et aucun effet sur le midazolam C max. Ainsi, une interaction entre l'ilopéridone et d'autres substrats du CYP3A4 est peu probable.
Médicaments qui prolongent l'intervalle QT FANAPT ne doit pas être utilisé avec d'autres médicaments qui prolongent l'intervalle QT.
Haut
Utilisation dans des populations spécifiques
Registre d'exposition à la grossesse
Il existe un registre d'exposition à la grossesse qui surveille les résultats de la grossesse chez les femmes exposées au FANAPT pendant la grossesse. Pour plus d'informations, contactez le Registre national de grossesse pour les antipsychotiques atypiques au 1-866-961-2388 ou visitez http://womensmentalhealth.org/clinical-and -programmes de recherche / registre de grossesse /.
Résumé des risques
Les nouveau-nés dont les mères sont exposées à des antipsychotiques, y compris FANAPT, au cours du troisième trimestre de la grossesse sont à risque de symptômes extrapyramidaux et / ou de sevrage après l'accouchement. Les données disponibles limitées avec FANAPT chez les femmes enceintes ne sont pas suffisantes pour informer sur le risque associé au médicament de malformations congénitales majeures et de fausses couches. L'ilopéridone n'était pas tératogène lorsqu'il était administré par voie orale à des rates gravides pendant l'organogenèse à des doses jusqu'à 26 fois la dose humaine maximale recommandée de 24 mg / jour en mg / m2. Cependant, il a prolongé la durée de la grossesse et de la mise bas, a augmenté les naissances mortes, les décès intra-utérins précoces, l'augmentation de l'incidence des retards de développement et la diminution de la survie des petits post-partum. L'ilopéridone n'était pas tératogène lorsqu'elle était administrée par voie orale à des lapines gravides pendant l'organogenèse à des doses allant jusqu'à 20 fois la MRHD en mg / m2. Cependant, il a augmenté les décès intra-utérins précoces et diminué la viabilité fœtale à terme à la dose la plus élevée qui était également une dose toxique pour la mère.
Le risque de fond d'anomalies congénitales majeures et de fausses couches pour la population indiquée est inconnu. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausses couches dans les grossesses cliniquement reconnues est de 2 à 4% et de 15 à 20%, respectivement.
Considérations cliniques
Effets indésirables fœtaux / néonatals
Symptômes extrapyramidaux et / ou de sevrage, y compris agitation, hypertonie, hypotonie, tremblements, somnolence, détresse respiratoire et des troubles alimentaires ont été signalés chez des nouveau-nés dont les mères ont été exposées à des antipsychotiques au cours du troisième trimestre de grossesse. Ces symptômes ont varié en gravité. Certains nouveau-nés se sont rétablis en quelques heures ou jours sans traitement spécifique; d'autres ont nécessité une hospitalisation prolongée. Surveiller les nouveau-nés à la recherche de symptômes extrapyramidaux et / ou de sevrage et gérer les symptômes de manière appropriée.
Les données
Données sur les animaux
Dans une étude sur le développement embryo-fœtal, des rates gravides ont reçu 4, 16 ou 64 mg / kg / jour (1,6, 6,5 et 26 fois la dose humaine maximale recommandée (MRHD) de 24 mg / jour en mg / m2) d'ilopéridone par voie orale pendant la période de organogenèse. La dose la plus élevée a provoqué une augmentation des décès intra-utérins précoces, une diminution du poids et de la longueur du fœtus, diminution de l'ossification du squelette fœtal et augmentation de l'incidence des anomalies mineures du squelette fœtal et variations; cette dose a également entraîné une diminution de la consommation alimentaire maternelle et une prise de poids.
Dans une étude sur le développement embryo-fœtal, des lapines gravides ont reçu 4, 10 ou 25 mg / kg / jour (3, 8 et 20 fois la MRHD en mg / m2) d'ilopéridone pendant la période d'organogenèse. La dose la plus élevée a provoqué une augmentation des décès intra-utérins précoces et une diminution de la viabilité fœtale à terme; cette dose a également provoqué une toxicité maternelle.
Dans des études supplémentaires dans lesquelles des rats ont reçu de l'ilopéridone à des doses similaires à ce qui précède à partir de la préconception ou de 17e jour de gestation et se poursuivant jusqu'au sevrage, les effets néfastes sur la reproduction comprenaient une grossesse et une parturition prolongées, taux de mortinatalité, incidence accrue des variations viscérales du fœtus, diminution du poids du fœtus et du chiot et diminution du chiot post-partum survie. Il n'y a eu aucun effet médicamenteux sur le développement neurocomportemental ou reproducteur des chiots survivants. Les doses sans effet variaient de 4 à 12 mg / kg, à l'exception de l'augmentation des taux de mortinatalité qui s'est produite à la plus faible dose testée de 4 mg / kg, ce qui représente 1,6 fois la MRHD en mg / m2. Une toxicité maternelle a été observée aux doses plus élevées dans ces études.
Le métabolite de l'ilopéridone P95, qui est un métabolite circulant majeur de l'ilopéridone chez l'homme, mais qui n'est pas présent dans a été administré à des rates gravides pendant la période d’organogenèse à des doses orales de 20, 80 ou 200 mg kg / jour. Aucun effet tératogène n'a été observé. Une ossification squelettique retardée s'est produite à toutes les doses. Aucune toxicité maternelle significative n'a été produite. Les concentrations plasmatiques de P95 (ASC) à la plus forte dose testée étaient 2 fois supérieures à celles observées chez l'homme recevant la MRHD d'ilopéridone.
Lactation
Résumé des risques
Il n'y a aucune information concernant la présence d'ilopéridone ou de ses métabolites dans le lait maternel, effets de l'ilopéridone sur un enfant allaité, ni effets de l'ilopéridone sur le lait maternel production. L'ilopéridone est présente dans le lait de rat. En raison du risque d'effets indésirables graves chez les nourrissons allaités, conseiller à une femme de ne pas allaiter pendant le traitement par FANAPT.
Données Le transfert de radioactivité dans le lait de rates allaitantes a été étudié après une dose unique d'ilopéridone [14C] à 5 mg / kg. La concentration de radioactivité dans le lait 4 heures après l'administration de la dose était près de 10 fois supérieure à celle du plasma en même temps. Cependant, 24 heures après l'administration, les concentrations de radioactivité dans le lait étaient tombées à des valeurs légèrement inférieures à celles du plasma. Le profil métabolique du lait était qualitativement similaire à celui du plasma.
Utilisation pédiatrique La sécurité et l'efficacité chez les patients pédiatriques et adolescents n'ont pas été établies.
Utilisation gériatrique
Les études cliniques de FANAPT dans le traitement de la schizophrénie n'ont pas inclus un nombre suffisant de patients âgés de 65 ans et plus pour déterminer s'ils répondent ou non différemment d'un adulte plus jeune les patients. Sur les 3210 patients traités par FANAPT dans les essais de précommercialisation, 25 (0,5%) avaient ≥ 65 ans et aucun patient ≥ 75 ans.
Les patients âgés atteints de psychose liée à la démence traités par FANAPT présentent un risque de décès accru par rapport au placebo. FANAPT n'est pas approuvé pour le traitement des patients atteints de psychose liée à la démence.
Insuffisance rénale
Étant donné que FANAPT est hautement métabolisé, moins de 1% du médicament étant excrété sous forme inchangée, une insuffisance rénale seule ne devrait pas avoir d'impact significatif sur la pharmacocinétique de FANAPT. L'insuffisance rénale (clairance de la créatinine <30 ml / min) a eu un effet minimal sur la Cmax de l'ilopéridone (administrée en une seule dose de 3 mg) et ses métabolites P88 et P95 dans l'un des 3 analytes mesurés. L'ASC0– ∞ a augmenté de 24%, diminué de 6% et augmenté de 52% pour l'ilopéridone, P88 et P95, respectivement, chez les sujets atteints d'insuffisance rénale.
Insuffisance hépatique
Aucun ajustement posologique de FANAPT n'est nécessaire chez les patients présentant une insuffisance hépatique légère. Les patients atteints d'insuffisance hépatique modérée peuvent nécessiter une réduction de la dose. FANAPT n'est pas recommandé chez les patients présentant une insuffisance hépatique sévère.
Chez les sujets adultes présentant une insuffisance hépatique légère, aucune différence significative dans la pharmacocinétique de l'ilopéridone, P88 ou P95 (totale ou non liée) n'a été observée par rapport aux témoins adultes sains. Chez les sujets présentant une insuffisance hépatique modérée, une exposition libre plus élevée (2 fois) et plus variable aux métabolites actifs P88 était observée par rapport aux témoins sains, tandis que l’exposition à l’ilopéridone et au P95 était généralement similaire (variation inférieure à 50% contrôle). Aucune étude n'ayant été menée auprès de sujets présentant une insuffisance hépatique sévère, FANAPT n'est pas recommandé pour les patients présentant une insuffisance hépatique sévère.
Statut de fumeur
D'après des études in vitro utilisant des enzymes hépatiques humaines, FANAPT n'est pas un substrat du CYP1A2; le tabagisme ne doit donc pas avoir d'effet sur la pharmacocinétique de FANAPT.
Grossesse
Haut
Abus et dépendance aux drogues
Substance contrôlée
FANAPT n'est pas une substance contrôlée.
Abuser de
FANAPT n'a pas été systématiquement étudié chez l'animal ou l'homme pour son potentiel d'abus, de tolérance ou de dépendance physique. Bien que les essais cliniques n'aient révélé aucune tendance au comportement de recherche de drogue, ces observations n'étaient pas systématiques et il n'est pas possible de prédire sur la base de cette expérience dans quelle mesure un médicament actif du SNC, le FANAPT, sera mal utilisé, détourné et / ou abusé une fois commercialisé. Par conséquent, les patients doivent être soigneusement évalués pour des antécédents d'abus de drogues, et ces patients doivent être observé de près pour des signes de mauvaise utilisation ou d'abus de FANAPT (par exemple, développement d'une tolérance, augmentation de la dose, recherche de drogue comportement).
Haut
Surdosage
Expérience humaine
Dans les essais de pré-commercialisation impliquant plus de 3210 patients, une surdose accidentelle ou intentionnelle de FANAPT a été documentée chez 8 patients allant de 48 mg à 576 mg pris en une fois et 292 mg pris en 3 jours période. Aucun décès n'a été signalé dans ces cas. La plus grande ingestion unique confirmée de FANAPT était de 576 mg; aucun effet physique indésirable n'a été noté pour ce patient. L'ingestion confirmée suivante la plus importante de FANAPT était de 438 mg sur une période de 4 jours; des symptômes extrapyramidaux et un intervalle QTc de 507 ms ont été rapportés pour ce patient sans séquelles cardiaques. Ce patient a repris le traitement par FANAPT pendant 11 mois supplémentaires.
En général, les signes et symptômes signalés étaient ceux résultant d'une exagération des effets pharmacologiques connus (par exemple, somnolence et sédation, tachycardie et hypotension) de FANAPT.
Gestion du surdosage
Il n'y a pas d'antidote spécifique pour FANAPT. Par conséquent, des mesures de soutien appropriées devraient être instituées. En cas de surdosage aigu, le médecin doit établir et maintenir une voie aérienne et assurer une oxygénation et une ventilation adéquates. Un lavage gastrique (après l'intubation, si le patient est inconscient) et l'administration de charbon activé avec un laxatif doivent être envisagés. La possibilité d'obturation, de convulsions ou de réaction dystonique de la tête et du cou après un surdosage peut créer un risque d'aspiration avec vomissements induits. La surveillance cardiovasculaire doit commencer immédiatement et doit inclure une surveillance ECG continue pour détecter d'éventuelles arythmies. Si un traitement antiarythmique est administré, le disopyramide, le procaïnamide et la quinidine ne doivent pas être utilisés, car ils ont le potentiel d'effets prolongeant l'intervalle QT qui pourraient s'ajouter à ceux de FANAPT. De même, il est raisonnable de s'attendre à ce que les propriétés alpha-bloquantes du brétylium s'ajoutent à celles du FANAPT, entraînant une hypotension problématique. L'hypotension et l'effondrement circulatoire doivent être traités avec des mesures appropriées telles que des liquides intraveineux ou des agents sympathomimétiques (l'épinéphrine et la dopamine ne doivent pas être utilisées, car la stimulation bêta peut aggraver l'hypotension dans le cadre de l'alpha induit par FANAPT blocus). En cas de symptômes extrapyramidaux sévères, un médicament anticholinergique doit être administré. Une surveillance médicale étroite doit se poursuivre jusqu'à la guérison du patient.
Haut
La description
FANAPT est un antipsychotique atypique appartenant à la classe chimique des dérivés de pipéridinyl-benzisoxazole. Son nom chimique est 4 ’- [3- [4- (6-Fluoro-1,2-benzisoxazol-3-yl) pipéridino] propoxy] -3’-méthoxyacétophénone. Sa formule moléculaire est C24H27FN2O4 et son poids moléculaire est 426,48. La formule structurelle est:
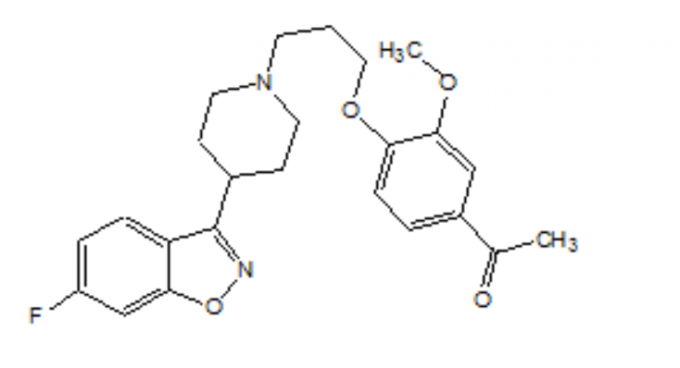
L'ilopéridone est une poudre finement cristalline blanche à blanc cassé. Il est pratiquement insoluble dans l'eau, très légèrement soluble dans HCl 0,1 N et librement soluble dans le chloroforme, l'éthanol, le méthanol et l'acétonitrile.
Les comprimés FANAPT sont destinés à une administration orale uniquement. Chaque tour, non couché
Le comprimé contient 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg ou 12 mg d'ilopéridone. Les ingrédients inactifs sont: le lactose monohydraté, la cellulose microcristalline, l'hydroxypropylméthylcellulose, la crospovidone, le stéarate de magnésium, le silicium colloïdal
dioxyde et eau purifiée (éliminés pendant le traitement). Les comprimés sont blancs, ronds, plats, à bords biseautés et identifiés par un logo «» gravé sur une face et la force du comprimé «1», «2», «4», «6», «8», «10», ou "12" en creux de l'autre côté.
Haut
Pharmacologie clinique
Mécanisme d'action
Le mécanisme d'action de l'ilopéridone dans la schizophrénie est inconnu. Cependant, l'efficacité de l'ilopéridone pourrait être médiée par une combinaison d'antagonisme de la dopamine de type 2 (D2) et de la sérotonine de type 2 (5-HT2).
L'ilopéridone forme un métabolite actif, le P88, qui a un profil de liaison aux récepteurs in vitro similaire au médicament parent.
Pharmacodynamique
L'ilopéridone agit comme un antagoniste avec une forte affinité (nM) se liant à la sérotonine 5-HT2A dopamine D2 et Récepteurs D3 et récepteurs de la noradrénaline NEα1 (valeurs Ki de 5,6, 6,3, 7,1 et 0,36 nM, respectivement). L'ilopéridone a une affinité modérée pour la dopamine D4 et les récepteurs de la sérotonine 5-HT6 et 5 -HT7 (valeurs Ki de 25, 43 et 22, nM respectivement) et une faible affinité pour les récepteurs de la sérotonine 5-HT1A, de la dopamine D1 et de l'histamine H1 (valeurs Ki de 168, 216 et 437 nM, respectivement). L'ilopéridone n'a pas d'affinité appréciable (Ki> 1000 nM) pour les récepteurs muscariniques cholinergiques. L'affinité du métabolite de l'ilopéridone P88 est généralement inférieure ou égale à celle du composé d'origine, tandis que le métabolite P95 seulement montre une affinité pour le 5-HT2A (valeur Ki de 3,91) et les récepteurs NEα1A, NEα1B, NEα1D et NEα2C (valeurs Ki de 4,7, 2,7, 8,8 et 4,7 nM respectivement).
Pharmacocinétique
Demi-vies d'élimination moyennes observées pour l'ilopéridone, P88 et P95 dans les métaboliseurs extensifs (EM) du CYP2D6 sont respectivement de 18, 26 et 23 heures et, chez les métaboliseurs lents (PM), de 33, 37 et 31 heures, respectivement. Les concentrations à l'état d'équilibre sont atteintes dans les 3 à 4 jours suivant l'administration. L'accumulation d'ilopéridone est prévisible à partir de la pharmacocinétique à dose unique. La pharmacocinétique de l'ilopéridone est plus que proportionnelle à la dose. L'élimination de l'ilopéridone se fait principalement par métabolisme hépatique impliquant 2 isozymes P450, CYP2D6 et CYP3A4.
Absorption: l'ilopéridone est bien absorbé après l'administration du comprimé, les concentrations plasmatiques maximales se produisant en 2 à 4 heures; tandis que la biodisponibilité relative de la formulation du comprimé par rapport à la solution buvable est de 96%. L'administration d'ilopéridone avec un repas riche en graisses standard n'a pas affecté de manière significative la Cmax ou l'ASC de l'ilopéridone, P88 ou P95, mais retardé Tmax de 1 heure pour l'ilopéridone, 2 heures pour P88 et 6 heures pour P95. FANAPT peut être administré sans égard aux repas.
Distribution: l'ilopéridone a une clairance apparente (clairance / biodisponibilité) de 47 à 102 L / h, avec un volume de distribution apparent de 1340-2800 L. Aux concentrations thérapeutiques, la fraction non liée d'ilopéridone dans le plasma est d'environ 3% et de chaque métabolite (P88 et P95), elle est d'environ 8%.
Métabolisme et élimination: l'ilopéridone est métabolisée principalement par 3 voies de biotransformation: réduction du carbonyle, hydroxylation (médiée par le CYP2D6) et O-déméthylation (médiée par le CYP3A4). Il existe 2 principaux métabolites de l'ilopéridone, P95 et P88. Le métabolite de l'ilopéridone P95 représente 47,9% de l'ASC de l'ilopéridone et de ses métabolites dans le plasma à l'état d'équilibre pour les métaboliseurs extensifs (EM) et 25% pour les métaboliseurs lents (PM). Le métabolite actif P88 représente respectivement 19,5% et 34,0% de l'exposition plasmatique totale en EM et PM.
Environ 7% -10% des Caucasiens et 3% -8% des Noirs / Afro-Américains n'ont pas la capacité de métaboliser le CYP2D6 substrats et sont classés comme métaboliseurs pauvres (PM), tandis que les autres sont intermédiaires, extensifs ou ultrarapides métaboliseurs. L'administration concomitante de FANAPT avec des inhibiteurs puissants connus du CYP2D6 comme la fluoxétine entraîne un facteur 2,3 augmentation de l'exposition plasmatique à l'ilopéridone, et donc la moitié de la dose de FANAPT doit être administré.
De même, les PM du CYP2D6 sont plus exposés à l'ilopéridone que les EM et les PM devraient voir leur dose réduite de moitié. Des tests de laboratoire sont disponibles pour identifier les PM du CYP2D6.
La majeure partie des matières radioactives a été récupérée dans l'urine (moyenne 58,2% et 45,1% respectivement dans l'EM et les PM), les matières fécales représentant 19,9% (EM) à 22,1% (PM) de la radioactivité dosée.
Interaction avec les transporteurs: l'ilopéridone et le P88 ne sont pas des substrats de la P-gp et l'ilopéridone est un faible inhibiteur de la P-gp.
Haut
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse: Des études de cancérogénicité à vie ont été menées sur des souris CD-1 et des rats Sprague Dawley. L'ilopéridone a été administrée par voie orale à des doses de 2,5, 5,0 et 10 mg / kg / jour à des souris CD-1 et à 4, 8 et 16 mg / kg / jour à Rats Sprague Dawley (0,5, 1,0 et 2,0 fois et 1,6, 3,2 et 6,5 fois, respectivement, la MRHD de 24 mg / jour sur un mg / m2 base). Il y avait une incidence accrue de tumeurs malignes des glandes mammaires chez les souris femelles traitées avec la dose la plus faible (2,5 mg / kg / jour) seulement. Aucune augmentation de la néoplasie liée au traitement n'a été observée chez le rat.
Le potentiel cancérogène du métabolite de l'ilopéridone P95, qui est un métabolite circulant majeur de l'ilopéridone chez l'homme, mais qui n'est pas présent en quantités importantes chez la souris ou chez le rat Wistar à des doses orales de 25, 75 et 200 mg / kg / jour chez l'homme et de 50, 150 et 250 (au lieu de 400) mg / kg / jour chez le rat les femelles. Des modifications néoplasiques liées au médicament se sont produites chez les hommes, dans l'hypophyse (adénome pars distalis) à toutes les doses et dans le pancréas (adénome à cellules d'îlots) à la dose élevée. Les concentrations plasmatiques de P95 (ASC) chez les hommes aux doses testées (25, 75 et 200 mg / kg / jour) étaient respectivement d'environ 0,4, 3 et 23 fois l'exposition humaine au P95 au MRHD de l'ilopéridone.
Mutagenèse: l'ilopéridone était négative dans le test d'Ames et dans les tests in vivo de moelle osseuse de souris et de micronoyau de foie de rat. L'ilopéridone a induit des aberrations chromosomiques dans des cellules ovariennes de hamster chinois (CHO) in vitro à des concentrations qui ont également provoqué une certaine cytotoxicité.
Le métabolite de l'ilopéridone P95 était négatif dans le test d'Ames, le test d'aberration chromosomique V79 et un test in vivo du micronoyau de la moelle osseuse de souris.
Altération de la fertilité: l'ilopéridone a diminué la fertilité à 12 et 36 mg / kg dans une étude dans laquelle des rats mâles et femelles ont été traités. La dose sans effet était de 4 mg / kg, soit 1,6 fois la MRHD de 24 mg / jour en mg / m2.
Haut
Etudes cliniques
L'efficacité de FANAPT dans le traitement de la schizophrénie a été confirmée par 2 placebo et essais à court terme contrôlés activement (4 et 6 semaines) et un essai randomisé à long terme contrôlé par placebo procès de retrait. Tous les essais ont recruté des patients qui répondaient aux critères DSM-III / IV de la schizophrénie.
Trois instruments ont été utilisés pour évaluer les signes et symptômes psychiatriques dans ces études. L'échelle du syndrome positif et négatif (PANSS) et l'échelle de notation psychiatrique brève (BPRS) sont toutes deux des inventaires à plusieurs éléments.
de la psychopathologie générale habituellement utilisée pour évaluer les effets du traitement médicamenteux dans la schizophrénie. L'évaluation Clinical Global Impression (CGI) reflète l'impression d'un observateur qualifié, parfaitement familiarisé avec les manifestations de la schizophrénie, sur l'état clinique général du patient.
Un essai contrôlé par placebo de 6 semaines (n = 706) a impliqué 2 gammes de doses flexibles de FANAPT (12-16 mg / jour ou 20-24 mg / jour) par rapport au placebo et à un contrôle actif (rispéridone). Pour le groupe 12-16 mg / jour, le schéma de titration de FANAPT était de 1 mg deux fois par jour aux jours 1 et 2, 2 mg deux fois par jour aux jours 3 et 4, 4 mg deux fois par jour aux jours 5 et 6 et 6 mg deux fois tous les jours le jour 7. Pour le groupe 20-24 mg / jour, le schéma de titration de FANAPT était de 1 mg deux fois par jour le jour 1, 2 mg deux fois par jour le jour 2, 4 mg deux fois par jour le jour 3, 6 mg deux fois par jour les jours 4 et 5, 8 mg deux fois par jour le jour 6 et 10 mg deux fois par jour le jour 7. Le critère d'évaluation principal était le changement par rapport à la valeur de référence sur le score total BPRS à la fin du traitement (jour 42). Les gammes de doses de 12 à 16 mg / jour et de 20 à 24 mg / jour de FANAPT étaient supérieures au placebo sur le score total BPRS. L'antipsychotique témoin actif a semblé être supérieur à FANAPT dans cet essai au cours des 2 premiers semaines, une conclusion qui peut être en partie expliquée par le titrage plus rapide qui a été possible pour cette drogue. Chez les patients de cette étude qui sont restés sous traitement pendant au moins 2 semaines, l'ilopéridone semble avoir eu une efficacité comparable à celle du contrôle actif.
Un essai contrôlé par placebo de 4 semaines (n = 604) a impliqué une dose fixe de FANAPT (24 mg / jour) par rapport au placebo et à un contrôle actif (ziprasidone). Le calendrier de titration de cette étude était similaire à celui de l'étude de 6 semaines. Cette étude impliquait une titration de FANAPT commençant à 1 mg deux fois par jour au jour 1 et augmentant à 2, 4, 6, 8, 10 et 12 mg deux fois par jour aux jours 2, 3, 4, 5, 6 et 7. Le critère d'évaluation principal était le changement par rapport à la valeur de référence sur le score total PANSS à la fin du traitement (jour 28). La dose de 24 mg / jour de FANAPT était supérieure au placebo dans le score total PANSS. FANAPT a semblé avoir une efficacité similaire au médicament témoin actif qui nécessitait également un titrage lent à la dose cible.
Dans un essai à plus long terme, des patients externes adultes cliniquement stables (n = 303) répondant aux critères DSM-IV pour la schizophrénie qui sont restés stables après 12 semaines de un traitement en ouvert avec des doses flexibles de FANAPT (8 mg / jour - 24 mg / jour administré en doses deux fois par jour) a été randomisé pour un placebo ou leur dose actuelle de FANAPT (8 mg / jour - 24 mg / jour administrée en doses deux fois par jour) pour l'observation d'une éventuelle rechute pendant la rechute en double aveugle phase de prévention. La stabilisation pendant la phase en ouvert a été définie comme étant une dose établie de FANAPT qui était inchangée en raison de son efficacité au cours des 4 semaines précédant la randomisation, ayant un score de gravité CGI ≤4 et un score PANSS total ≤70, un score ≤4 pour chacun des éléments PANSS individuels suivants (délires P1, désorganisation conceptuelle P2, Comportement hallucinatoire P3, suspicion / persécution P6, hostilité P7 ou non-coopération G8), et aucune hospitalisation ni augmentation du niveau de soins à traiter exacerbations. La rechute ou la rechute imminente pendant la phase de prévention des rechutes en double aveugle a été définie comme suivants: hospitalisation pour aggravation de la schizophrénie, augmentation (aggravation) du score total PANSS ≥30%, CGI-
Score d'amélioration ≥ 6, le patient avait un comportement suicidaire, homicide ou agressif, ou avait besoin de tout autre médicament antipsychotique.

Sur la base de l'analyse intermédiaire, un comité indépendant de surveillance des données a décidé que l'étude devait être interrompue tôt en raison de preuves d'efficacité. Sur la base des résultats de l'analyse intermédiaire, confirmés par l'ensemble de données d'analyse final, les patients traités par FANAPT a connu un temps de rechute ou une rechute imminente statistiquement plus long que les patients ayant reçu placebo. La figure 1 montre la proportion cumulée estimée de patients avec rechute ou rechute imminente sur la base de l'ensemble de données final.
Haut
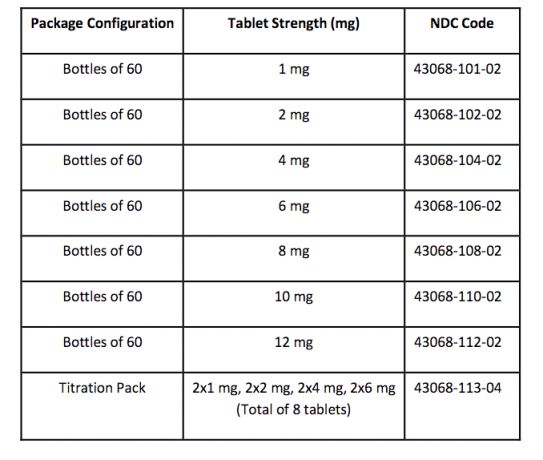
Comment fournis / stockage et manutention
Les comprimés FANAPT sont blancs, ronds et identifiés par un logo gravé sur un côté et la force des comprimés "1", "2", "4", "6", "8", "10" ou "12" gravés sur l'autre côté. Les comprimés sont fournis dans les forces et les configurations d'emballage suivantes:
Espace de rangement
Conservez les comprimés FANAPT à température ambiante contrôlée, 25 ° C (77 ° F); excursions permises à 15 ° à 30 ° C (59 ° à 86 ° F) [Voir la température ambiante contrôlée USP]. Protégez les comprimés FANAPT de l'exposition à la lumière et à l'humidité.
RENSEIGNEMENTS D'ASSISTANCE AUX PATIENTS
Il est conseillé aux médecins de discuter des problèmes suivants avec les patients auxquels ils prescrivent FANAPT:
Prolongation de l'intervalle QT
Il faut conseiller aux patients de consulter immédiatement leur médecin s'ils se sentent mal, perdent connaissance ou ont des palpitations cardiaques. Il faut conseiller aux patients de ne pas prendre FANAPT avec d'autres médicaments qui provoquent un allongement de l'intervalle QT. Les patients doivent être informés d'informer les médecins qu'ils prennent FANAPT avant de prendre tout nouveau médicament.
Syndrome malin des neuroleptiques
Les patients et les soignants doivent être informés qu'un complexe de symptômes potentiellement mortel est parfois référé comme NMS a été signalé en association avec l'administration d'antipsychotiques, y compris FANAPT. Les signes et symptômes du SMN comprennent l'hyperpyrexie, la rigidité musculaire, une altération de l'état mental et des signes d'autonomie
instabilité (pouls ou pression artérielle irréguliers, tachycardie, diaphorèse et dysrythmie cardiaque).
Changements métaboliques
Les patients doivent être conscients des symptômes de l'hyperglycémie (taux élevé de sucre dans le sang) et du diabète sucré. Les patients qui reçoivent un diagnostic de diabète, ceux qui présentent des facteurs de risque de diabète ou ceux qui en développent les symptômes pendant le traitement doivent faire l'objet d'une surveillance de leur glycémie au début et périodiquement traitement. Les patients doivent être informés qu'un gain de poids s'est produit pendant le traitement par FANAPT. Une surveillance clinique du poids est recommandée.
Hypotension orthostatique
Les patients doivent être informés du risque d'hypotension orthostatique, en particulier au moment de l'initiation du traitement, de la reprise du traitement ou de l'augmentation de la dose.
Interférence avec les performances cognitives et motrices
Étant donné que FANAPT peut potentiellement altérer le jugement, la réflexion ou la motricité, les patients doivent être avertis utiliser des machines dangereuses, y compris des automobiles, jusqu'à ce qu'elles soient raisonnablement convaincues que la thérapie FANAPT ne les affecte pas défavorablement.
Grossesse
Informez les patients que l'utilisation de Fanapt au troisième trimestre peut provoquer des symptômes extrapyramidaux et / ou de sevrage chez le nouveau-né. Conseillez aux patientes d'aviser leur fournisseur de soins de santé d'une grossesse connue ou suspectée.
Registre de grossesse
Informer les patientes qu'il existe un registre d'exposition à la grossesse qui surveille les résultats de la grossesse chez les femmes exposées au FANAPT pendant la grossesse
Lactation
Conseillez aux femmes de ne pas allaiter pendant le traitement par FANAPT.
Médicament concomitant
Il faut conseiller aux patients d'informer leur médecin s'ils prennent ou envisagent de prendre des médicaments sur ordonnance ou en vente libre, car il existe un risque d'interactions.
De l'alcool
Il faut conseiller aux patients d'éviter l'alcool pendant qu'ils prennent FANAPT.
Exposition à la chaleur et déshydratation
Les patients doivent être informés des soins appropriés à éviter en cas de surchauffe et de déshydratation.
Distribué par:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 États-Unis
Vanda et Fanapt® sont des marques déposées de Vanda Pharmaceuticals Inc. aux États-Unis et dans d'autres pays.
retour au sommet
Guide de prescription de Fanapt (ilopéridone) (PDF)
Les informations contenues dans cette monographie ne sont pas destinées à couvrir toutes les utilisations, directions, précautions, interactions médicamenteuses ou effets indésirables possibles. Ces informations sont généralisées et ne sont pas destinées à un avis médical spécifique. Si vous avez des questions sur les médicaments que vous prenez ou si vous souhaitez plus d'informations, consultez votre médecin, votre pharmacien ou votre infirmière.
dernière mise à jour 07/13
retour à: Page d'accueil de Pharmacologie des médicaments psychiatriques



