Lantus pour le traitement du diabète
Nom de la marque: Lantus
Nom générique: insuline glargine
Forme posologique: Injection (Lantus ne doit PAS être dilué ou mélangé avec une autre insuline ou solution)
Contenu:
La description
Pharmacologie clinique
Indications et usage
Contre-indications
Avertissements
Précautions
Effets indésirables
Dosage et administration
Comment est fourni
Lantus, insuline glargine (origine ADNr), information du patient (en anglais simple)
La description
Lantus® (injection d'insuline glargine [origine ADNr]) est une solution stérile d'insuline glargine à utiliser en injection. L'insuline glargine est un analogue de l'insuline humaine recombinante qui est un hypoglycémiant parentéral à action prolongée (jusqu'à 24 heures d'action). (Voir PHARMACOLOGIE CLINIQUE). Lantus est produit par la technologie de l'ADN recombinant en utilisant une souche de laboratoire non pathogène d'Escherichia coli (K12) comme organisme de production. L'insuline glargine diffère de l'insuline humaine en ce que l'aminoacide asparagine en position A21 est remplacé par la glycine et deux arginines sont ajoutées à l'extrémité C-terminale de la chaîne B. Chimiquement, il s'agit de l'insuline humaine 21A-Gly-30Ba-L-Arg-30Bb-L-Arg-et a la formule empirique C267H404N72O78S6 et un poids moléculaire de 6063. Il a la formule structurelle suivante:
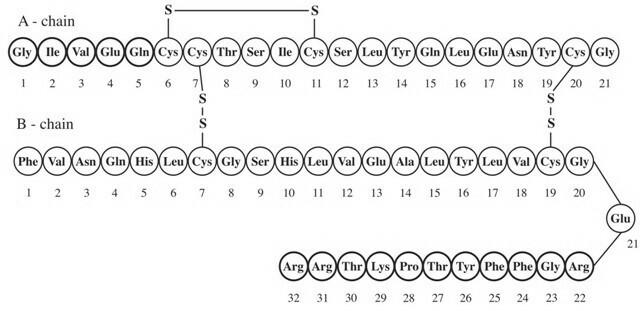
Lantus se compose d'insuline glargine dissoute dans un liquide aqueux clair. Chaque millilitre de Lantus (injection d'insuline glargine) contient 100 UI (3,6378 mg) d'insuline glargine.
Les ingrédients inactifs du flacon de 10 ml sont 30 mcg de zinc, 2,7 mg de m-crésol, 20 mg de glycérol à 85%, 20 mcg de polysorbate 20 et de l'eau pour injection.
Les ingrédients inactifs de la cartouche de 3 ml sont 30 mcg de zinc, 2,7 mg de m-crésol, 20 mg de glycérol à 85% et de l'eau pour injection.
Le pH est ajusté par addition de solutions aqueuses d'acide chlorhydrique et d'hydroxyde de sodium. Lantus a un pH d'environ 4.
Haut
Pharmacologie clinique
Mécanisme d'action
L'activité principale de l'insuline, y compris l'insuline glargine, est la régulation du métabolisme du glucose. L'insuline et ses analogues abaissent la glycémie en stimulant l'absorption périphérique de glucose, en particulier par les muscles squelettiques et les graisses, et en inhibant la production de glucose hépatique. L'insuline inhibe la lipolyse dans l'adipocyte, inhibe la protéolyse et améliore la synthèse des protéines.
Pharmacodynamique
L'insuline glargine est un analogue de l'insuline humaine qui a été conçu pour avoir une faible solubilité aqueuse à pH neutre. A pH 4, comme dans la solution injectable Lantus, il est totalement soluble. Après injection dans le tissu sous-cutané, la solution acide est neutralisée, conduisant à la formation de microprécipités à partir desquels de petites des quantités d'insuline glargine sont libérées lentement, ce qui se traduit par un profil concentration / temps relativement constant sur 24 heures sans de pointe. Ce profil permet l'administration une fois par jour de l'insuline basale d'un patient.
Dans les études cliniques, l'effet hypoglycémiant sur une base molaire (c'est-à-dire lorsqu'il est administré aux mêmes doses) d'insuline glargine intraveineuse est approximativement le même que l'insuline humaine. Dans les études sur la pince euglycémique chez des sujets sains ou chez des patients atteints de diabète de type 1, le début d'action de l'insuline glargine sous-cutanée a été plus lent que celui de l'insuline humaine NPH. Le profil d'effet de l'insuline glargine était relativement constant sans pic prononcé et la durée de son effet était prolongée par rapport à l'insuline humaine NPH. La figure 1 montre les résultats d'une étude chez des patients atteints de diabète de type 1 menée pendant un maximum de 24 heures après l'injection. Le temps médian entre l'injection et la fin de l'effet pharmacologique était de 14,5 heures (intervalle: 9,5 à 19,3 heures) pour NPH l'insuline humaine et 24 heures (intervalle: 10,8 à> 24,0 heures) (24 heures était la fin de la période d'observation) pour l'insuline glargine.
Figure 1. Profil d'activité chez les patients atteints de diabète de type 1 »
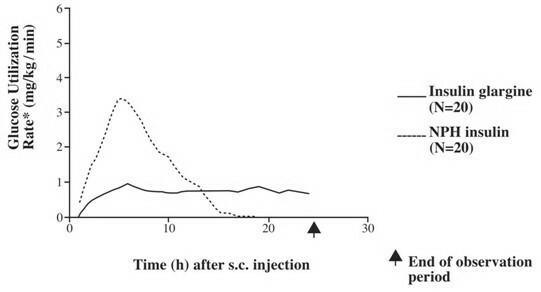
* Déterminé comme la quantité de glucose infusée pour maintenir des niveaux de glucose plasmatique constants (valeurs moyennes horaires); indicatif de l'activité de l'insuline.
â Variabilité entre patients (CV, coefficient de variation); insuline glargine, 84% et NPH, 78%.
La durée d'action plus longue (jusqu'à 24 heures) de Lantus est directement liée à son taux d'absorption plus lent et prend en charge l'administration sous-cutanée une fois par jour. La durée d'action des insulines, y compris Lantus, peut varier entre les individus et / ou au sein d'un même individu.
Pharmacocinétique
Absorption et biodisponibilité
Après injection sous-cutanée d'insuline glargine chez des sujets sains et des patients diabétiques, les concentrations sériques d'insuline ont indiqué une absorption plus lente et plus prolongée et un profil concentration / temps relativement constant sur 24 heures sans pic prononcé par rapport à l'HNP humain insuline. Les concentrations sériques d'insuline étaient donc cohérentes avec le profil temporel de l'activité pharmacodynamique de l'insuline glargine.
Après injection sous-cutanée de 0,3 UI / kg d'insuline glargine chez des patients atteints de diabète de type 1, un profil concentration / temps relativement constant a été démontré. La durée d'action après administration sous-cutanée abdominale, deltoïde ou de la cuisse était similaire.
Métabolisme
Une étude du métabolisme chez l'homme indique que l'insuline glargine est partiellement métabolisée à l'extrémité carboxyle de la chaîne B sous-cutanée dépôt pour former deux métabolites actifs avec une activité in vitro similaire à celle de l'insuline, M1 (21A-Gly-insuline) et M2 (21A-Gly-des-30B-Thr-insuline). Le médicament inchangé et ces produits de dégradation sont également présents dans la circulation.
Populations spéciales
Âge, race et sexe
Aucune information sur l'effet de l'âge, de la race et du sexe sur la pharmacocinétique de Lantus n'est disponible. Cependant, dans les essais cliniques contrôlés chez l'adulte (n = 3890) et dans un essai clinique contrôlé chez les patients pédiatriques (n = 349), sous-groupe les analyses basées sur l'âge, la race et le sexe n'ont pas montré de différences de sécurité et d'efficacité entre l'insuline glargine et l'HNP humain insuline.
Fumeur
L'effet du tabagisme sur la pharmacocinétique / pharmacodynamique de Lantus n'a pas été étudié.
Grossesse
L'effet de la grossesse sur la pharmacocinétique et la pharmacodynamique de Lantus n'a pas été étudié (voir PRÉCAUTIONS, Grossesse).
Obésité
Dans les essais cliniques contrôlés, qui incluaient des patients ayant un indice de masse corporelle (IMC) allant jusqu'à 49,6 kg / m2 inclus, Les analyses de sous-groupe basées sur l'IMC n'ont montré aucune différence de sécurité et d'efficacité entre l'insuline glargine et NPH humain insuline.
Insuffisance rénale
L'effet de l'insuffisance rénale sur la pharmacocinétique de Lantus n'a pas été étudié. Cependant, certaines études sur l'insuline humaine ont montré une augmentation des taux d'insuline circulante chez les patients atteints d'insuffisance rénale. Une surveillance attentive de la glycémie et des ajustements de la dose d'insuline, y compris Lantus, peuvent être nécessaires chez les patients présentant une dysfonction rénale (voir PRÉCAUTIONS, Insuffisance rénale).
Insuffisance hépatique
L'effet de l'insuffisance hépatique sur la pharmacocinétique de Lantus n'a pas été étudié. Cependant, certaines études sur l'insuline humaine ont montré une augmentation des taux d'insuline circulante chez les patients insuffisants hépatiques. Une surveillance attentive de la glycémie et des ajustements de la dose d'insuline, y compris Lantus, peuvent être nécessaires chez les patients présentant une dysfonction hépatique (voir PRÉCAUTIONS, Insuffisance hépatique).
Etudes cliniques
La sécurité et l'efficacité de l'insuline glargine administrée une fois par jour au coucher ont été comparées à celles de l'insuline humaine NPH une fois par jour et deux fois par jour en ouvert, randomisée, études parallèles à contrôle actif portant sur 2327 patients adultes et 349 patients pédiatriques atteints de diabète sucré de type 1 et 1563 patients adultes atteints de diabète sucré de type 2 (voir tableaux 1-3). En général, la réduction de l'hémoglobine glyquée (HbA1c) avec Lantus était similaire à celle avec l'insuline humaine NPH. Les taux globaux d'hypoglycémie ne différaient pas entre les patients diabétiques traités par Lantus par rapport à l'insuline humaine NPH.
Diabète de type 1 - adulte (voir tableau 1).
Dans deux grandes études cliniques contrôlées randomisées (études A et B), des patients atteints de diabète de type 1 (étude A; n = 585, étude B; n = 534) ont été randomisés pour un traitement en bol basal avec Lantus une fois par jour au coucher ou pour l'insuline humaine NPH une ou deux fois par jour et traités pendant 28 semaines. De l'insuline humaine régulière a été administrée avant chaque repas. Lantus a été administré au coucher. L'insuline humaine NPH a été administrée une fois par jour au coucher ou le matin et au coucher lorsqu'elle a été utilisée deux fois par jour. Dans une grande étude clinique randomisée et contrôlée (étude C), des patients atteints de diabète de type 1 (n = 619) ont été traités pendant 16 semaines avec un régime d'insuline à bol basal où l'insuline lispro a été utilisée avant chaque repas. Lantus a été administré une fois par jour au coucher et l'insuline humaine NPH a été administrée une ou deux fois par jour. Dans ces études, l'insuline humaine Lantus et NPH a eu un effet similaire sur la glycohémoglobine avec un taux global d'hypoglycémie similaire.
Tableau 1: Diabète sucré de type 1 - adulte
| Etude A | Etude B | Étude C | ||||
|---|---|---|---|---|---|---|
| Durée du traitement | 28 semaines | 28 semaines | 16 semaines | |||
| Traitement en combinaison avec | Insuline régulière | Insuline régulière | Insuline lispro | |||
| Lantus | NPH | Lantus | NPH | Lantus | NPH | |
| Nombre de sujets traités | 292 | 293 | 264 | 270 | 310 | 309 |
| HbA1c | ||||||
| Endstudy mean | 8.13 | 8.07 | 7.55 | 7.49 | 7.53 | 7.60 |
| Adj. changement moyen par rapport à la ligne de base | +0.21 | +0.10 | -0.16 | -0.21 | -0.07 | -0.08 |
| Lantus - NPH | +0.11 | +0.05 | +0.01 | |||
| IC à 95% pour la différence de traitement | (-0.03; +0.24) | (-0.08; +0.19) | (-0.11; +0.13) | |||
| Dose d'insuline basale | ||||||
| Endstudy mean | 19.2 | 22.8 | 24.8 | 31.3 | 23.9 | 29.2 |
| Changement moyen par rapport à la ligne de base | -1.7 | -0.3 | -4.1 | +1.8 | -4.5 | +0.9 |
| Dose d'insuline totale | ||||||
| Endstudy mean | 46.7 | 51.7 | 50.3 | 54.8 | 47.4 | 50.7 |
| Changement moyen par rapport à la ligne de base | -1.1 | -0.1 | +0.3 | +3.7 | -2.9 | +0.3 |
| Glycémie à jeun (mg / dL) | ||||||
| Endstudy mean | 146.3 | 150.8 | 147.8 | 154.4 | 144.4 | 161.3 |
| Adj. changement moyen par rapport à la ligne de base | -21.1 | -16.0 | -20.2 | -16.9 | -29.3 | -11.9 |
Diabète de type 1 pédiatrique (voir le tableau 2).
Dans une étude clinique contrôlée randomisée (étude D), des patients pédiatriques (tranche d'âge 6 à 15 ans) atteints de diabète de type 1 (n = 349) ont été traités pendant 28 semaines avec un régime d'insuline à bol basal où de l'insuline humaine régulière a été utilisée avant chaque repas. Lantus a été administré une fois par jour au coucher et l'insuline humaine NPH a été administrée une ou deux fois par jour. Des effets similaires sur la glycohémoglobine et l'incidence d'hypoglycémie ont été observés dans les deux groupes de traitement.
Tableau 2: Diabète sucré de type 1 - pédiatrique
| Etude D | ||
|---|---|---|
| Durée du traitement | 28 semaines | |
| Traitement en combinaison avec | Insuline régulière | |
| Lantus | NPH | |
| Nombre de sujets traités | 174 | 175 |
| HbA1c | ||
| Endstudy mean | 8.91 | 9.18 |
| Adj. changement moyen par rapport à la ligne de base | +0.28 | +0.27 |
| Lantus - NPH | +0.01 | |
| IC à 95% pour la différence de traitement | (-0.24; +0.26) | |
| Dose d'insuline basale | ||
| Endstudy mean | 18.2 | 21.1 |
| Changement moyen par rapport à la ligne de base | -1.3 | +2.4 |
| Dose d'insuline totale | ||
| Endstudy mean | 45.0 | 46.0 |
| Changement moyen par rapport à la ligne de base | +1.9 | +3.4 |
| Glycémie à jeun (mg / dL) | ||
| Endstudy mean | 171.9 | 182.7 |
| Adj. changement moyen par rapport à la ligne de base | -23.2 | -12.2 |
Diabète de type 2 - adulte (voir tableau 3).
Dans une grande étude clinique randomisée et contrôlée (étude E) (n = 570), Lantus a été évalué pendant 52 semaines dans le cadre d'un régime de traitement d'association avec l'insuline et des antidiabétiques oraux (une sulfonylurée, la metformine, l'acarbose ou une combinaison de ces drogues). Lantus administré une fois par jour au coucher était aussi efficace que l'insuline humaine NPH administrée une fois par jour au coucher pour réduire la glycohémoglobine et le glucose à jeun. Il y avait un faible taux d'hypoglycémie qui était similaire chez les patients traités par l'insuline humaine Lantus et NPH. Dans une grande étude clinique randomisée et contrôlée (étude F), chez des patients atteints de diabète de type 2 n'utilisant pas d'agents antidiabétiques oraux (n = 518), un régime de bolus basal de Lantus une fois par jour au coucher ou de l'insuline humaine NPH administrée une ou deux fois par jour a été évalué pour 28 semaines. De l'insuline humaine régulière a été utilisée avant les repas au besoin. Lantus avait une efficacité similaire à celle de l'insuline humaine NPH une ou deux fois par jour pour réduire la glycohémoglobine et le glucose à jeun avec une incidence d'hypoglycémie similaire.
Tableau 3: Diabète sucré de type 2 - adulte
| Etude E | Étude F | |||
|---|---|---|---|---|
| Durée du traitement | 52 semaines | 28 semaines | ||
| Traitement en combinaison avec | Agents oraux | Insuline régulière | ||
| Lantus | NPH | Lantus | NPH | |
| Nombre de sujets traités | 289 | 281 | 259 | 259 |
| HbA1c | ||||
| Endstudy mean | 8.51 | 8.47 | 8.14 | 7.96 |
| Adj. changement moyen par rapport à la ligne de base | -0.46 | -0.38 | -0.41 | -0.59 |
| Lantus - NPH | -0.08 | +0.17 | ||
| IC à 95% pour la différence de traitement | (-0.28; +0.12) | (-0.00; +0.35) | ||
| Dose d'insuline basale | ||||
| Endstudy mean | 25.9 | 23.6 | 42.9 | 52.5 |
| Changement moyen par rapport à la ligne de base | +11.5 | +9.0 | -1.2 | +7.0 |
| Dose d'insuline totale | ||||
| Endstudy mean | 25.9 | 23.6 | 74.3 | 80.0 |
| Changement moyen par rapport à la ligne de base | +11.5 | +9.0 | +10.0 | +13.1 |
| Glycémie à jeun (mg / dL) | ||||
| Endstudy mean | 126.9 | 129.4 | 141.5 | 144.5 |
| Adj. changement moyen par rapport à la ligne de base | -49.0 | -46.3 | -23.8 | -21.6 |
Dosage quotidien flexible de Lantus
L'innocuité et l'efficacité de Lantus administré avant le petit déjeuner, avant le dîner ou au coucher étaient évalué dans une grande étude clinique randomisée et contrôlée, chez des patients atteints de diabète de type 1 (étude G, n = 378). Les patients ont également été traités par insuline lispro au moment des repas. Lantus administré à différents moments de la journée a entraîné des réductions similaires de l'hémoglobine glyquée par rapport à l'administration au coucher (voir le tableau 4). Chez ces patients, les données sont disponibles à partir de la surveillance du glucose à domicile en 8 points. La glycémie moyenne maximale a été observée juste avant l'injection de Lantus, quelle que soit l'heure d'administration, c'est-à-dire avant le petit-déjeuner, avant le dîner ou au coucher.
Dans cette étude, 5% des patients du bras Lantus-breakfast ont arrêté le traitement en raison d'un manque d'efficacité. Aucun patient dans les deux autres bras n'a arrêté pour cette raison. Une surveillance de routine au cours de cet essai a révélé les changements moyens suivants de la pression artérielle systolique: groupe pré-petit-déjeuner, 1,9 mm Hg; groupe avant le dîner, 0,7 mm Hg; groupe avant le coucher, -2,0 mm Hg.
L'innocuité et l'efficacité de Lantus administré avant le petit déjeuner ou au coucher ont également été évaluées dans un grand étude clinique contrôlée active (étude H, n = 697) chez des patients diabétiques de type 2 qui ne sont plus contrôlés adéquatement par voie orale thérapie. Tous les patients de cette étude ont également reçu AMARYL® (glimépiride) 3 mg par jour. Lantus administré avant le petit déjeuner était au moins aussi efficace pour abaisser l'hémoglobine glyquée A1c (HbA1c) que Lantus administré au coucher ou l'insuline humaine NPH administrée au coucher (voir le tableau 4).
Tableau 4: Dosage quotidien flexible de Lantus dans le diabète sucré de type 1 (étude G) et de type 2 (étude H)
| Étude G | Étude H | |||||
|---|---|---|---|---|---|---|
| Durée du traitement | 24 semaines | 24 semaines | ||||
| Traitement en combinaison avec: | Insuline lispro | AMARYL® (glimépiride) | ||||
| Lantus Petit déjeuner |
Lantus Dîner |
Lantus Heure du coucher |
Lantus Petit déjeuner |
Lantus Heure du coucher |
NPH Heure du coucher |
|
| ||||||
| Nombre de sujets traités* | 112 | 124 | 128 | 234 | 226 | 227 |
| HbA1c | ||||||
| Moyenne de référence | 7.56 | 7.53 | 7.61 | 9.13 | 9.07 | 9.09 |
| Endstudy mean | 7.39 | 7.42 | 7.57 | 7.87 | 8.12 | 8.27 |
| Changement moyen par rapport à la ligne de base | -0.17 | -0.11 | -0.04 | -1.26 | -0.95 | -0.83 |
| Dose d'insuline basale (UI) | ||||||
| Endstudy mean | 27.3 | 24.6 | 22.8 | 40.4 | 38.5 | 36.8 |
| Changement moyen par rapport à la ligne de base | 5.0 | 1.8 | 1.5 | |||
| Dose d'insuline totale (UI) | NAâ € | N / A | N / A | |||
| Endstudy mean | 53.3 | 54.7 | 51.5 | |||
| Changement moyen par rapport à la ligne de base | 1.6 | 3.0 | 2.3 |
Haut
Indications et usage
Lantus est indiqué pour l'administration sous-cutanée une fois par jour pour le traitement des patients adultes et pédiatriques de type 1 le diabète sucré ou les patients adultes atteints de diabète sucré de type 2 qui ont besoin d'insuline basale (à action prolongée) pour contrôler hyperglycémie.
Haut
Contre-indications
Lantus est contre-indiqué chez les patients hypersensibles à l'insuline glargine ou aux excipients.
Haut
Avertissements
L'hypoglycémie est l'effet indésirable le plus courant de l'insuline, y compris Lantus. Comme pour toutes les insulines, le moment de l'hypoglycémie peut différer selon les différentes formulations d'insuline. La surveillance du glucose est recommandée pour tous les patients diabétiques.
Tout changement d'insuline doit être effectué avec prudence et uniquement sous surveillance médicale. Changements dans la force de l'insuline, le moment de l'administration, le fabricant, le type (par exemple, régulier, NPH ou analogues de l'insuline), l'espèce (animale, humaine), ou la méthode de fabrication (ADN recombinant versus insuline d'origine animale) peut entraîner la nécessité dosage. Un traitement antidiabétique oral concomitant peut nécessiter un ajustement.
Haut
Précautions
Général
Lantus n'est pas destiné à une administration intraveineuse. La durée d'activité prolongée de l'insuline glargine dépend de l'injection dans le tissu sous-cutané. L'administration intraveineuse de la dose sous-cutanée habituelle peut entraîner une hypoglycémie sévère.
Lantus ne doit PAS être dilué ou mélangé avec une autre insuline ou solution. Si Lantus est dilué ou mélangé, la solution peut devenir trouble et le profil pharmacocinétique / pharmacodynamique (par exemple, début de l'action, délai avant le pic d'effet) de Lantus et / ou de l'insuline mixte peuvent être modifiés de manière imprévisible manière. Lorsque Lantus et l'insuline humaine ordinaire ont été mélangés immédiatement avant l'injection chez le chien, un début d'action retardé et un délai d'effet maximal pour l'insuline humaine régulière ont été observés. La biodisponibilité totale du mélange a également été légèrement diminuée par rapport aux injections séparées de Lantus et d'insuline humaine ordinaire. La pertinence de ces observations chez le chien pour l'homme n'est pas connue.
Comme pour toutes les préparations d'insuline, la durée d'action de Lantus peut varier selon les individus ou à différents fois chez le même individu et le taux d'absorption dépend de l'apport sanguin, de la température et de activité.
L'insuline peut provoquer une rétention de sodium et un œdème, en particulier si un contrôle métabolique auparavant médiocre est amélioré par une insulinothérapie intensifiée.
Hypoglycémie
Comme pour toutes les préparations d'insuline, des réactions hypoglycémiques peuvent être associées à l'administration de Lantus. L'hypoglycémie est l'effet indésirable le plus courant des insulines. Les symptômes d'alerte précoce de l'hypoglycémie peuvent être différents ou moins prononcés dans certaines conditions, durée du diabète, maladie du nerf diabétique, utilisation de médicaments tels que les bêta-bloquants ou contrôle intensif du diabète (voir PRÉCAUTIONS, Interactions médicamenteuses). De telles situations peuvent entraîner une hypoglycémie grave (et, éventuellement, une perte de conscience) avant que les patients ne soient conscients de l'hypoglycémie.
Le moment d'apparition de l'hypoglycémie dépend du profil d'action des insulines utilisées et peut donc changer lorsque le schéma thérapeutique ou le moment de l'administration est modifié. Les patients qui passent de l'insuline NPH deux fois par jour à Lantus une fois par jour doivent Dose de Lantus réduite de 20% par rapport à la dose quotidienne quotidienne totale de NPH pour réduire le risque d'hypoglycémie (voir DOSAGE ET ADMINISTRATION, Passage à Lantus).
L'effet prolongé de Lantus sous-cutané peut retarder la guérison d'une hypoglycémie.
Dans une étude clinique, les symptômes d'hypoglycémie ou de réponses hormonales contre-régulatrices étaient similaires après insuline glargine intraveineuse et insuline humaine régulière à la fois chez les sujets sains et les patients de type 1 Diabète.
Insuffisance rénale
Bien qu'aucune étude n'ait été réalisée chez les patients atteints de diabète et d'insuffisance rénale, les exigences de Lantus peut être diminué en raison de la réduction du métabolisme de l'insuline, semblable aux observations trouvées avec d'autres insulines (voir PHARMACOLOGIE CLINIQUE, Populations spéciales).
Insuffisance hépatique
Bien qu'aucune étude n'ait été réalisée chez les patients atteints de diabète et d'insuffisance hépatique, les besoins en Lantus peuvent être diminués en raison d'une capacité réduite de gluconéogenèse et d'un métabolisme de l'insuline réduit, semblable aux observations trouvées avec d'autres insulines (voir PHARMACOLOGIE CLINIQUE, Populations spéciales).
Site d'injection et réactions allergiques
Comme pour toute insulinothérapie, une lipodystrophie peut survenir au site d'injection et retarder l'absorption de l'insuline. Les autres réactions au site d'injection avec l'insulinothérapie comprennent la rougeur, la douleur, les démangeaisons, l'urticaire, l'enflure et l'inflammation. Une rotation continue du site d'injection dans une zone donnée peut aider à réduire ou à prévenir ces réactions. La plupart des réactions mineures aux insulines disparaissent généralement en quelques jours à quelques semaines.
Les cas de douleur au site d'injection étaient plus fréquents avec Lantus qu'avec l'insuline humaine NPH (2,7% d'insuline glargine contre 0,7% NPH). Les cas de douleur au site d'injection étaient généralement légers et n'ont pas entraîné l'arrêt du traitement.
Les réactions allergiques de type immédiat sont rares. De telles réactions à l'insuline (y compris l'insuline glargine) ou aux excipients peuvent, par exemple, être associées avec réactions cutanées généralisées, œdème de Quincke, bronchospasme, hypotension ou choc et pouvant être à vie menaçant.
Conditions intercurrentes
Les besoins en insuline peuvent être modifiés lors de conditions intercurrentes telles que maladie, troubles émotionnels ou stress.
Information pour les patients
Lantus ne doit être utilisé que si la solution est limpide et incolore sans particules visibles (voir DOSAGE ET ADMINISTRATION, Préparation et manipulation).
Les patients doivent être informés que Lantus ne doit PAS être dilué ou mélangé avec une autre insuline ou solution (voir PRÉCAUTIONS, Général).
Les patients doivent être informés des procédures d'autogestion, y compris la surveillance de la glycémie, la technique d'injection appropriée et la gestion de l'hypoglycémie et de l'hyperglycémie. Les patients doivent être informés de la gestion de situations spéciales telles que les conditions intercurrentes (maladie, stress ou émotions perturbations), une dose d'insuline inadéquate ou sautée, l'administration par inadvertance d'une dose d'insuline accrue, un apport alimentaire insuffisant, ou repas sautés. Renvoyez les patients à la circulaire Lantus «Information patient» pour plus d'informations.
Comme pour tous les patients diabétiques, la capacité de concentration et / ou de réaction peut être altérée en raison d'une hypoglycémie ou d'une hyperglycémie.
Il faut conseiller aux patientes diabétiques d'informer leur professionnel de la santé si elles sont enceintes ou envisagent une grossesse.
Interactions médicamenteuses
Un certain nombre de substances affectent le métabolisme du glucose et peuvent nécessiter un ajustement de la dose d'insuline et en particulier une surveillance étroite.
Voici des exemples de substances qui peuvent augmenter l'effet hypoglycémiant et la sensibilité à l'hypoglycémie: produits antidiabétiques oraux, Inhibiteurs de l'ECA, disopyramide, fibrates, fluoxétine, inhibiteurs de la MAO, propoxyphène, salicylates, analogue de la somatostatine (p. Ex. Octréotide), sulfonamide antibiotiques.
Voici des exemples de substances susceptibles de réduire l'effet hypoglycémiant de l'insuline: corticostéroïdes, danazol, diurétiques, agents sympathomimétiques (par exemple, épinéphrine, albuterol, terbutaline), isoniazide, dérivés de la phénothiazine, somatropine, hormones thyroïdiennes, oestrogènes, progestatifs (p. ex. dans les contraceptifs oraux), inhibiteurs de protéase et antipsychotiques atypiques (p. ex. olanzapine et clozapine).
Les bêta-bloquants, la clonidine, les sels de lithium et l'alcool peuvent potentialiser ou affaiblir l'effet hypoglycémiant de l'insuline. La pentamidine peut provoquer une hypoglycémie, qui peut parfois être suivie d'une hyperglycémie.
De plus, sous l'influence de médicaments sympatholytiques tels que les bêta-bloquants, la clonidine, la guanéthidine et la réserpine, les signes d'hypoglycémie peuvent être réduits ou absents.
Carcinogenèse, mutagenèse, altération de la fertilité
Chez la souris et le rat, des études standard de cancérogénicité de deux ans avec l'insuline glargine ont été réalisées à des doses allant jusqu'à 0,455 mg / kg, ce qui est pour le rat. environ 10 fois et pour la souris environ 5 fois la dose initiale sous-cutanée recommandée de 10 UI (0,008 mg / kg / jour), sur la base de mg / m2. Les résultats chez les souris femelles n'étaient pas concluants en raison d'une mortalité excessive dans tous les groupes de dose au cours de l'étude. Des histiocytomes ont été trouvés aux sites d'injection chez des rats mâles (statistiquement significatifs) et des souris mâles (non statistiquement significatifs) dans des groupes contenant des véhicules acides. Ces tumeurs n'ont pas été trouvées chez les animaux femelles, dans les groupes témoins salins ou les groupes de comparaison d'insuline utilisant un véhicule différent. La pertinence de ces résultats pour l'homme n'est pas connue.
L'insuline glargine ne s'est pas révélée mutagène lors des tests de détection des mutations génétiques dans les bactéries et les cellules de mammifères (Ames- et Test HGPRT) et dans les tests de détection des aberrations chromosomiques (cytogénétique in vitro sur cellules V79 et in vivo en chinois hamsters).
Dans une étude combinée de fertilité et prénatale et postnatale chez des rats mâles et femelles à des doses sous-cutanées allant jusqu'à 0,36 mg / kg / jour, soit environ 7 fois la la dose initiale sous-cutanée recommandée de 10 UI (0,008 mg / kg / jour), basée sur le mg / m2, la toxicité maternelle due à une hypoglycémie dose-dépendante, y compris certains décès, a été observé. Par conséquent, une réduction du taux d'élevage s'est produite uniquement dans le groupe à forte dose. Des effets similaires ont été observés avec l'insuline humaine NPH.
Grossesse
Effets tératogènes
Catégorie de grossesse C. Des études de reproduction sous-cutanée et de tératologie ont été réalisées avec l'insuline glargine et l'insuline humaine régulière chez le rat et le lapin himalayen. Le médicament a été administré à des rats femelles avant l'accouplement, pendant l'accouplement et tout au long de la grossesse à des doses allant jusqu'à 0,36 mg / kg / jour, qui est environ 7 fois la dose initiale sous-cutanée recommandée de 10 UI (0,008 mg / kg / jour) chez l'homme, d'après mg / m2. Chez le lapin, des doses de 0,072 mg / kg / jour, soit environ 2 fois la dose recommandée chez l'homme une dose initiale sous-cutanée de 10 UI (0,008 mg / kg / jour), basée sur le mg / m2, a été administrée pendant organogenèse. Les effets de l'insuline glargine ne diffèrent généralement pas de ceux observés avec l'insuline humaine régulière chez le rat ou le lapin. Cependant, chez le lapin, cinq fœtus de deux portées du groupe à forte dose ont présenté une dilatation des ventricules cérébraux. La fertilité et le développement embryonnaire précoce semblaient normaux.
Il n'y a pas d'études cliniques bien contrôlées sur l'utilisation de l'insuline glargine chez la femme enceinte. Il est essentiel pour les patientes atteintes de diabète ou ayant des antécédents de diabète gestationnel de maintenir un bon contrôle métabolique avant la conception et tout au long de la grossesse. Les besoins en insuline peuvent diminuer au cours du premier trimestre, augmenter généralement au cours des deuxième et troisième trimestres et diminuer rapidement après l'accouchement. Une surveillance attentive du contrôle de la glycémie est essentielle chez ces patients. Étant donné que les études de reproduction animale ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la gestation que si cela est clairement nécessaire.
Mères allaitantes
On ne sait pas si l'insuline glargine est excrétée en quantités importantes dans le lait maternel. De nombreux médicaments, dont l'insuline humaine, sont excrétés dans le lait maternel. Pour cette raison, la prudence s'impose lorsque Lantus est administré à une femme qui allaite. Les femmes qui allaitent peuvent nécessiter des ajustements de la dose d'insuline et du régime alimentaire.
Utilisation pédiatrique
L'innocuité et l'efficacité de Lantus ont été établies dans le groupe d'âge de 6 à 15 ans atteint de diabète de type 1.
Utilisation gériatrique
Dans des études cliniques contrôlées comparant l'insuline glargine à l'insuline humaine NPH, 593 des 3890 patients atteints de diabète de type 1 et de type 2 avaient 65 ans et plus. La seule différence d'innocuité ou d'efficacité dans cette sous-population par rapport à l'ensemble de la population étudiée était une incidence plus élevée attendue d'événements cardiovasculaires à la fois sur l'insuline glargine et sur l'insuline humaine NPH les patients.
Chez les patients âgés atteints de diabète, la posologie initiale, les augmentations de dose et la posologie d'entretien doivent être prudentes pour éviter les réactions hypoglycémiques. L'hypoglycémie peut être difficile à reconnaître chez les personnes âgées (voir PRÉCAUTIONS, Hypoglycémie).
Haut
Effets indésirables
Les événements indésirables couramment associés à Lantus sont les suivants:
Corps dans son ensemble: réactions allergiques (voir PRÉCAUTIONS).
Peau et appendices: réaction au point d'injection, lipodystrophie, prurit, éruption cutanée (voir PRÉCAUTIONS).
Autre: hypoglycémie (voir AVERTISSEMENTS et PRÉCAUTIONS).
Dans les études cliniques chez les patients adultes, il y avait une incidence plus élevée de douleur au point d'injection émergente chez les patients traités par Lantus (2,7%) par rapport aux patients traités par insuline NPH (0,7%). Les cas de douleur au site d'injection étaient généralement légers et n'ont pas entraîné l'arrêt du traitement. D'autres réactions au point d'injection émergentes du traitement sont survenues à des incidences similaires avec l'insuline glargine et l'insuline humaine NPH.
La rétinopathie a été évaluée dans les études cliniques au moyen des événements indésirables rétiniens rapportés et de la photographie du fond d'œil. Le nombre d'événements indésirables rétiniens signalés pour les groupes de traitement Lantus et NPH était similaire pour les patients atteints de diabète de type 1 et de type 2. La progression de la rétinopathie a été étudiée par photographie du fond d'œil en utilisant un protocole de classement dérivé de l'étude sur le traitement précoce de la rétinopathie diabétique (ETDRS). Dans une étude clinique impliquant des patients atteints de diabète de type 2, une différence dans le nombre de sujets avec â ¥ 3 étapes une progression de l'échelle ETDRS sur une période de 6 mois a été notée par la photographie du fond d'œil (7,5% dans le groupe Lantus contre 2,7% dans NPH groupe traité). La pertinence globale de cette observation isolée ne peut être déterminée en raison du petit nombre de patients impliqués, la courte période de suivi et le fait que cette constatation n’ait pas été observée dans d’autres études.
Haut
Surdosage
Un excès d'insuline par rapport à l'apport alimentaire, à la dépense énergétique ou aux deux peut entraîner une hypoglycémie sévère et parfois à long terme et potentiellement mortelle. Les épisodes légers d'hypoglycémie peuvent généralement être traités avec des glucides oraux. Des ajustements de la posologie du médicament, des modes de repas ou de l'exercice peuvent être nécessaires.
Des épisodes plus graves avec coma, convulsions ou troubles neurologiques peuvent être traités avec du glucagon intramusculaire / sous-cutané ou du glucose intraveineux concentré. Après une récupération clinique apparente de l'hypoglycémie, une observation continue et un apport supplémentaire en glucides peuvent être nécessaires pour éviter la réapparition de l'hypoglycémie.
Haut
Dosage et administration
Lantus est un analogue de l'insuline humaine recombinante. Sa puissance est approximativement la même que celle de l'insuline humaine. Il présente un profil hypoglycémiant relativement constant sur 24 heures qui permet un dosage une fois par jour.
Lantus peut être administré à tout moment de la journée. Lantus doit être administré par voie sous-cutanée une fois par jour à la même heure chaque jour. Pour les patients qui ajustent le moment de l'administration de Lantus, voir AVERTISSEMENTS et PRÉCAUTIONS, Hypoglycémie. Lantus n'est pas destiné à l'administration intraveineuse (voir PRÉCAUTIONS). L'administration intraveineuse de la dose sous-cutanée habituelle peut entraîner une hypoglycémie sévère. Les niveaux de glycémie souhaités ainsi que les doses et le calendrier des médicaments antidiabétiques doivent être déterminés individuellement. La surveillance de la glycémie est recommandée pour tous les patients diabétiques. La durée d'activité prolongée de Lantus dépend de l'injection dans l'espace sous-cutané.
Comme pour toutes les insulines, les sites d'injection dans une zone d'injection (abdomen, cuisse ou deltoïde) doivent être tournés d'une injection à l'autre.
Dans les études cliniques, il n'y avait pas de différence significative dans l'absorption d'insuline glargine après administration sous-cutanée abdominale, deltoïde ou de la cuisse. Comme pour toutes les insulines, le taux d'absorption, et par conséquent le début et la durée de l'action, peuvent être affectés par l'exercice et d'autres variables.
Lantus n'est pas l'insuline de choix pour le traitement de l'acidocétose diabétique. L'insuline intraveineuse à courte durée d'action est le traitement préféré.
Utilisation pédiatrique
Lantus peut être administré en toute sécurité aux patients pédiatriques âgés de 6 ans et plus. Administration aux patients pédiatriques
Initiation de la thérapie Lantus
Dans une étude clinique portant sur des patients naïfs d'insuline atteints de diabète de type 2 déjà traités par des médicaments antidiabétiques oraux, Lantus a une dose moyenne de 10 UI une fois par jour, puis ajustée en fonction des besoins du patient à une dose quotidienne totale allant de 2 à 100 IU.
Passage à Lantus
Si vous passez d'un schéma thérapeutique avec une insuline à action intermédiaire ou longue à un schéma posologique avec Lantus, la quantité et le moment de l'insuline à action rapide ou de l'analogue d'insuline à action rapide ou la dose de tout médicament antidiabétique oral ajusté. Dans les études cliniques, lorsque les patients ont été transférés de l'insuline humaine NPH une fois par jour ou de l'insuline humaine ultralente à Lantus une fois par jour, la dose initiale n'a généralement pas été modifiée. Cependant, lorsque les patients ont été transférés de l'insuline humaine NPH deux fois par jour à Lantus une fois par jour, afin de réduire le risque d'hypoglycémie, la dose (UI) a été généralement réduite d'environ 20% (par rapport à la quantité quotidienne totale d'insuline humaine NPH), puis ajustée en fonction de la réponse du patient (voir PRÉCAUTIONS, Hypoglycémie).
Un programme de surveillance métabolique étroite sous surveillance médicale est recommandé pendant le transfert et dans les premières semaines par la suite. La quantité et le moment de l'insuline à action rapide ou de l'analogue d'insuline à action rapide peuvent devoir être ajustés. Cela est particulièrement vrai pour les patients avec des anticorps acquis à l'insuline humaine nécessitant des doses élevées d'insuline et se produit avec tous les analogues de l'insuline. Un ajustement de la dose de Lantus et d'autres insulines ou antidiabétiques oraux peut être nécessaire; par exemple, si le moment du dosage, la modification du poids ou du mode de vie du patient ou d'autres circonstances surviennent qui augmentent la sensibilité à l'hypoglycémie ou à l'hyperglycémie (voir PRÉCAUTIONS, Hypoglycémie).
Il peut également être nécessaire d'ajuster la dose pendant une maladie intercurrente (voir PRÉCAUTIONS, Conditions intercurrentes).
Préparation et manipulation
Les médicaments parentéraux doivent être inspectés visuellement avant l'administration chaque fois que la solution et le contenant le permettent. Lantus ne doit être utilisé que si la solution est limpide et incolore sans particules visibles.
Mélange et dilution: Lantus ne doit PAS être dilué ou mélangé avec une autre insuline ou solution (voir PRÉCAUTIONS, Général).
Flacon: Les seringues ne doivent contenir aucun autre médicament ni résidu.
Système de cartouche: Si OptiClik®, le dispositif d'administration d'insuline pour Lantus, fonctionne mal, Lantus peut être aspiré du système de cartouche dans une seringue U-100 et injecté.
Haut
Comment est fourni
Lantus 100 unités par ml (U-100) est disponible dans les formats d'emballage suivants:
Flacons de 10 ml (NDC 0088-2220-33)
Système de cartouches de 3 ml1, paquet de 5 (NDC 0088-2220-52)
1Les systèmes de cartouches sont destinés à être utilisés uniquement dans OptiClik® (dispositif d'administration d'insuline)
Espace de rangement
Système de flacon / cartouche non ouvert
Les flacons Lantus non ouverts et les systèmes de cartouches doivent être conservés au réfrigérateur, entre 36 ° F et 46 ° F (2 ° C et 8 ° C). Lantus ne doit pas être conservé au congélateur et ne doit pas geler.
Jeter s'il a été congelé.
Système de flacon / cartouche ouvert (en cours d'utilisation)
Les flacons ouverts, réfrigérés ou non, doivent être utilisés dans les 28 jours suivant la première utilisation. Ils doivent être jetés s'ils ne sont pas utilisés dans les 28 jours. Si la réfrigération n'est pas possible, le flacon ouvert peut être conservé non réfrigéré jusqu'à 28 jours à l'abri de la chaleur et de la lumière directes, tant que la température ne dépasse pas 86 ° F (30 ° C).
Le système de cartouche ouvert (en cours d'utilisation) dans OptiClik® ne doit PAS être réfrigéré mais doit être conservé à température ambiante (inférieure à 86 ° F [30 ° C]) à l'abri de la chaleur et de la lumière directes. Le système de cartouche ouvert (en cours d'utilisation) d'OptiClik® conservé à température ambiante doit être jeté après 28 jours. Ne conservez jamais OptiClik®, avec ou sans système de cartouche, au réfrigérateur.
Lantus ne doit pas être conservé au congélateur et ne doit pas geler. Jeter s'il a été congelé.
Ces conditions de stockage sont résumées dans le tableau suivant:
| Hors service (non ouvert) Réfrigéré |
Hors service (non ouvert) Température ambiante |
Utilisé (ouvert) (Voir la température ci-dessous) |
|
|---|---|---|---|
| Flacon de 10 ml | Jusqu'à la date d'expiration | 28 jours | 28 jours Réfrigéré ou température ambiante |
| Système de cartouche de 3 ml | Jusqu'à la date d'expiration | 28 jours | 28 jours Réfrigéré ou température ambiante |
| Cartouche de 3 ml système inséré dans OptiClik® |
28 jours Température ambiante uniquement (Ne pas réfrigérer) |
Fabriqué pour une distribution par:
sanofi-aventis U.S. LLC
Bridgewater NJ 08807
Fabriqué en Allemagne
www. Lantus.com
© 2006 sanofi-aventis U.S. LLC
OptiClik® est une marque déposée de sanofi-aventis U.S. LLC, Bridgewater NJ 08807
dernière mise à jour 04/2006
Lantus, insuline glargine (origine ADNr), information du patient (en anglais simple)
Informations détaillées sur les signes, les symptômes, les causes et les traitements du diabète
Les informations contenues dans cette monographie ne sont pas destinées à couvrir toutes les utilisations, directions, précautions, interactions médicamenteuses ou effets indésirables possibles. Ces informations sont généralisées et ne sont pas destinées à un avis médical spécifique. Si vous avez des questions sur les médicaments que vous prenez ou si vous souhaitez plus d'informations, consultez votre médecin, votre pharmacien ou votre infirmière.
retour à: Parcourir tous les médicaments pour le diabète



