Janumet pour le traitement du diabète
Nom de marque: Janumet
Nom générique: sitagliptine et chlorhydrate de metformine
Contenu:
Indications et usage
Dosage et administration
Formes posologiques et forces
Contre-indications
Avertissements et precautions
Effets indésirables
Interactions médicamenteuses
Utilisation dans des populations spécifiques
Surdosage
La description
Pharmacologie
Toxicologie non clinique
Etudes cliniques
Comment fournie
Information sur le counseling des patients
Janumet, Sitagliptin and Metformin Hydrochloride, Information pour les patients (en anglais simple)
AVERTISSEMENT: ACIDOSE LACTIQUE
L'acidose lactique est une complication rare mais grave qui peut survenir en raison de l'accumulation de metformine. Le risque augmente avec des conditions telles que la septicémie, la déshydratation, la consommation excessive d'alcool, l'insuffisance hépatique, l'insuffisance rénale et l'insuffisance cardiaque congestive aiguë.
L'apparition est souvent subtile, accompagnée uniquement de symptômes non spécifiques tels que malaise, myalgies, détresse respiratoire, somnolence croissante et détresse abdominale non spécifique. Les anomalies de laboratoire incluent un pH bas, une augmentation de l'écart anionique et une élévation du lactate sanguin.
En cas de suspicion d'acidose, Janumet1 doit être interrompu et le patient hospitalisé immédiatement. [Voir Avertissements et precautions]
Indications et usage
Janumet est indiqué en complément du régime alimentaire et de l'exercice pour améliorer le contrôle glycémique chez les adultes atteints de diabète sucré de type 2 lorsqu'un traitement à la fois par la sitagliptine et la metformine est approprié. [Voir Etudes cliniques.]
Limitations d'utilisation importantes
Janumet ne doit pas être utilisé chez les patients atteints de diabète de type 1 ou pour le traitement de l'acidocétose diabétique, car il ne serait pas efficace dans ces contextes.
Janumet n'a pas été étudié en association avec l'insuline.
Haut
Dosage et administration
Dosage recommandé
La posologie du traitement antihyperglycémiant avec Janumet doit être individualisée en fonction du régime actuel du patient, efficacité et tolérabilité sans dépasser la dose quotidienne maximale recommandée de 100 mg de sitagliptine et de 2000 mg metformine. Le traitement d'association initial ou le maintien du traitement d'association doit être individualisé et laissé à la discrétion du fournisseur de soins de santé.
Janumet doit généralement être administré deux fois par jour avec les repas, avec une augmentation progressive de la dose, afin de réduire les effets secondaires gastro-intestinaux (GI) dus à la metformine.
La dose initiale de Janumet doit être basée sur le schéma thérapeutique actuel du patient. Janumet doit être administré deux fois par jour avec les repas. Les doses suivantes sont disponibles:
50 mg de sitagliptine / 500 mg de chlorhydrate de metformine
50 mg de sitagliptine / 1000 mg de chlorhydrate de metformine.
Patients insuffisamment contrôlés par le régime et l'exercice seuls
Si le traitement par un comprimé combiné contenant de la sitagliptine et de la metformine est jugé approprié pour un patient atteint de diabète sucré de type 2 insuffisamment contrôlé par le régime et l'exercice seuls, la dose initiale recommandée est de 50 mg de sitagliptine / 500 mg de chlorhydrate de metformine deux fois du quotidien. Les patients dont le contrôle glycémique est insuffisant à cette dose peuvent être titrés jusqu'à 50 mg de sitagliptine / 1000 mg de chlorhydrate de metformine deux fois par jour.
Patients insuffisamment contrôlés sous monothérapie à la metformine
Si le traitement par un comprimé combiné contenant de la sitagliptine et de la metformine est jugé approprié pour un patient insuffisamment contrôlé par la metformine seule, la dose initiale recommandée de Janumet devrait fournir la sitagliptine dosée à 50 mg deux fois par jour (dose quotidienne totale de 100 mg) et la dose de metformine déjà pris. Pour les patients prenant 850 mg de metformine deux fois par jour, la dose initiale recommandée de Janumet est de 50 mg de sitagliptine / 1000 mg de chlorhydrate de metformine deux fois par jour.
Patients insuffisamment contrôlés sous monothérapie par la sitagliptine
Si le traitement par un comprimé combiné contenant de la sitagliptine et de la metformine est jugé approprié pour un patient contrôlée par la sitagliptine seule, la dose initiale recommandée de Janumet est de 50 mg de sitagliptine / 500 mg de chlorhydrate de metformine deux fois du quotidien. Les patients avec un contrôle insuffisant sur cette dose peuvent être titrés jusqu'à 50 mg de sitagliptine / 1000 mg de chlorhydrate de metformine deux fois par jour. Les patients prenant de la sitagliptine en monothérapie ajustés en fonction de l'insuffisance rénale ne doivent pas passer à Janumet [voir Contre-indications].
Patients abandonnant la co-administration de sitagliptine et de metformine
Pour les patients qui passent de la sitagliptine en association avec la metformine, Janumet peut être initié à la dose de sitagliptine et de metformine déjà prises.
Patients insuffisamment contrôlés sous bithérapie avec deux des antihyperglycémiants suivants: sitagliptine, metformine ou sulfonylurée
Si un traitement par un comprimé combiné contenant de la sitagliptine et de la metformine est jugé approprié dans la dose initiale habituelle de Janumet devrait fournir de la sitagliptine dosée à 50 mg deux fois par jour (100 mg au total dose quotidienne). Pour déterminer la dose initiale du composant metformine, le niveau de contrôle glycémique du patient et la dose actuelle (le cas échéant) de metformine doivent être pris en compte. Une augmentation progressive de la dose pour réduire les effets secondaires gastro-intestinaux (GI) associés à la metformine doit être envisagée. Les patients qui suivent ou commencent une sulfonylurée peuvent nécessiter des doses de sulfonylurée plus faibles pour réduire le risque d'hypoglycémie [voir Avertissements et precautions].
Aucune étude n'a été spécifiquement menée sur l'innocuité et l'efficacité de Janumet chez des patients précédemment traités par d'autres antihyperglycémiants oraux et passés à Janumet. Tout changement dans la thérapie du diabète de type 2 doit être entrepris avec soin et surveillance appropriée car des changements dans le contrôle glycémique peuvent se produire.
Haut
Formes posologiques et forces
- Les comprimés à 50 mg / 500 mg sont des comprimés pelliculés rose clair, en forme de capsule, portant l'inscription «575» gravée sur une face.
- Les comprimés à 50 mg / 1000 mg sont des comprimés rouges, en forme de capsule, pelliculés avec l'inscription «577» gravée sur une face.
Haut
Contre-indications
Janumet (sitagliptine / metformine HCl) est contre-indiqué chez les patients présentant:
- Maladie rénale ou dysfonction rénale, par exemple, comme le suggèrent les taux sériques de créatinine - 1,5 mg / dL [mâles], - 1,4 mg / dL [femmes] ou anormal clairance de la créatinine qui peut également résulter de conditions telles que l'effondrement cardiovasculaire (choc), l'infarctus aigu du myocarde et la septicémie [voir Avertissements et precautions].
- Acidose métabolique aiguë ou chronique, y compris acidocétose diabétique, avec ou sans coma.
- Antécédents de réaction d'hypersensibilité grave à Janumet ou à la sitagliptine (l'un des composants de Janumet), telle que l'anaphylaxie ou l'œdème de Quincke. [Voir Avertissements et precautions et Effets indésirables.]
Janumet doit être temporairement interrompu chez les patients soumis à des études radiologiques impliquant des l'administration de produits de contraste iodés, car l'utilisation de ces produits peut entraîner une altération aiguë de fonction [voir Avertissements et precautions].
Haut
Avertissements et precautions
Acidose lactique
Chlorhydrate de metformine
L'acidose lactique est une complication métabolique rare, mais grave, qui peut survenir en raison de l'accumulation de metformine pendant le traitement par Janumet; lorsqu'elle survient, elle est mortelle dans environ 50% des cas. L'acidose lactique peut également se produire en association avec un certain nombre de conditions physiopathologiques, y compris le diabète sucré, et chaque fois qu'il existe une hypoperfusion tissulaire et une hypoxémie importantes. L'acidose lactique se caractérise par des niveaux élevés de lactate sanguin (> 5 mmol / L), une diminution du pH sanguin, des perturbations électrolytiques avec un écart anionique accru et un rapport lactate / pyruvate accru. Lorsque la metformine est impliquée comme cause de l'acidose lactique, des taux plasmatiques de metformine> 5 μg / mL sont généralement trouvés.
L'incidence rapportée d'acidose lactique chez les patientes recevant du chlorhydrate de metformine est très faible (environ 0,03 cas / 1000 patients-années, avec environ 0,015 cas mortels / 1000 années-patients). Dans plus de 20 000 patients-années d'exposition à la metformine dans les essais cliniques, aucun cas d'acidose lactique n'a été signalé. Les cas signalés sont survenus principalement chez des patients diabétiques présentant une insuffisance rénale significative, y compris des maladie et hypoperfusion rénale, souvent dans le cadre de problèmes médicaux / chirurgicaux concomitants multiples et concomitants multiples médicaments. Les patients souffrant d'insuffisance cardiaque congestive nécessitant une prise en charge pharmacologique, en particulier ceux présentant une l'insuffisance cardiaque congestive aiguë qui est à risque d'hypoperfusion et d'hypoxémie, sont à risque accru de lactique acidose. Le risque d'acidose lactique augmente avec le degré de dysfonctionnement rénal et l'âge du patient. Le risque d'acidose lactique peut donc être significativement diminué par une surveillance régulière de la fonction rénale chez les patients prenant de la metformine et par l'utilisation de la dose efficace minimale de metformine. En particulier, le traitement des personnes âgées doit être accompagné d'une surveillance attentive de la fonction rénale. Le traitement par la metformine ne doit pas être instauré chez les patients âgés de 80 ans ou moins, sauf si la mesure de la clairance de la créatinine démontre que la fonction rénale n'est pas réduite, car ces patients sont plus susceptibles de développer une acidose lactique. De plus, la metformine doit être rapidement suspendue en présence de toute condition associée à une hypoxémie, une déshydratation ou une septicémie. Étant donné que la fonction hépatique altérée peut limiter considérablement la capacité d'éliminer le lactate, la metformine doit généralement être évitée chez les patients présentant des signes cliniques ou biologiques de maladie hépatique. Les patients doivent être mis en garde contre une consommation excessive d'alcool, aiguë ou chronique, lorsqu'ils prennent de la metformine, car l'alcool potentialise les effets du chlorhydrate de metformine sur le métabolisme du lactate. De plus, la metformine doit être temporairement interrompue avant toute étude de contraste radiologique intravasculaire et pour toute intervention chirurgicale [voir Avertissements et precautions].
Le début de l'acidose lactique est souvent subtil et accompagné uniquement de symptômes non spécifiques tels que malaise, myalgies, détresse respiratoire, augmentation de la somnolence et détresse abdominale non spécifique. Il peut y avoir une hypothermie, une hypotension et des bradyarythmies résistantes associées à une acidose plus marquée. Le patient et le médecin du patient doivent être conscients de l’importance possible de tels symptômes et le patient doit être informé d’en informer immédiatement le médecin s’ils surviennent [voir Avertissements et precautions]. La metformine doit être retirée jusqu'à ce que la situation soit clarifiée. Les électrolytes sériques, les cétones, la glycémie et, si indiqué, le pH sanguin, les taux de lactate et même les taux sanguins de metformine peuvent être utiles. Une fois qu'un patient est stabilisé à n'importe quel niveau de dose de metformine, il est peu probable que les symptômes gastro-intestinaux, qui sont courants au début du traitement, soient liés au médicament. La survenue tardive de symptômes gastro-intestinaux pourrait être due à une acidose lactique ou à une autre maladie grave.
Les taux de lactate de plasma veineux à jeun supérieurs à la limite supérieure de la normale mais inférieurs à 5 mmol / L chez les patients prenant de la metformine n'indiquent pas nécessairement une lactation imminente l'acidose et peut être expliquée par d'autres mécanismes, tels que le diabète ou l'obésité mal contrôlé, une activité physique vigoureuse ou des problèmes techniques dans la manipulation des échantillons [voir Avertissements et precautions].
L'acidose lactique doit être suspectée chez tout patient diabétique présentant une acidose métabolique sans preuve d'acidocétose (cétonurie et cétonémie).
L'acidose lactique est une urgence médicale qui doit être traitée en milieu hospitalier. Chez un patient atteint d'acidose lactique qui prend de la metformine, le médicament doit être arrêté immédiatement et des mesures de soutien générales doivent être rapidement mises en place. Parce que le chlorhydrate de metformine est dialysable (avec une clairance allant jusqu'à 170 mL / min sous une bonne hémodynamique hémodialyse rapide est recommandée pour corriger l'acidose et éliminer les accumulations metformine. Une telle prise en charge entraîne souvent une inversion rapide des symptômes et un rétablissement [voir Contre-indications; Avertissements et precautions].
Fonction hépatique altérée
Étant donné que l'insuffisance hépatique a été associée à certains cas d'acidose lactique, Janumet doit généralement être évité chez les patients présentant des signes cliniques ou biologiques de maladie hépatique.
Évaluation de la fonction rénale
La metformine et la sitagliptine sont largement excrétées par les reins. Le risque d'accumulation de metformine et d'acidose lactique augmente avec le degré d'insuffisance de la fonction rénale. Ainsi, les patients présentant des taux sériques de créatinine supérieurs à la limite supérieure de la normale pour leur âge ne doivent pas recevoir Janumet. Chez les personnes âgées, Janumet doit être soigneusement titré pour établir la dose minimale pour un effet glycémique adéquat, car le vieillissement peut être associé à une fonction rénale réduite. [Voir Avertissements et precautions et Utilisation dans des populations spécifiques.]
Avant le début du traitement par Janumet et au moins une fois par an par la suite, la fonction rénale doit être évaluée et vérifiée comme étant normale. Chez les patients chez qui le développement d'un dysfonctionnement rénal est anticipé, en particulier chez les patients âgés, doit être évaluée plus fréquemment et Janumet doit être arrêté si des signes d'insuffisance rénale sont présent.
Vitamine B12 Les niveaux
Dans les essais cliniques contrôlés de metformine d'une durée de 29 semaines, une diminution à des niveaux sous-normaux de vitamine B sérique auparavant normale12 des taux sans manifestations cliniques ont été observés chez environ 7% des patients. Cette diminution, peut-être due à une interférence avec B12 absorption du B12complexe de facteurs intrinsèques, est cependant très rarement associé à l'anémie et semble être rapidement réversible avec l'arrêt de la metformine ou de la vitamine B12 supplémentation. La mesure des paramètres hématologiques sur une base annuelle est conseillée chez les patients sous Janumet et toute anomalie apparente doit être étudiée et gérée de manière appropriée. [Voir Effets indésirables.]
Certaines personnes (celles qui ont une vitamine B insuffisante12 ou apport ou absorption de calcium) semblent être prédisposés à développer une vitamine B anormale12 les niveaux. Chez ces patients, la vitamine B sérique de routine12 des mesures à des intervalles de deux à trois ans peuvent être utiles.
Prise d'alcool
L'alcool est connu pour potentialiser l'effet de la metformine sur le métabolisme du lactate. Par conséquent, les patients doivent être mis en garde contre la consommation excessive d'alcool, aiguë ou chronique, lorsqu'ils reçoivent Janumet.
Interventions chirurgicales
L'utilisation de Janumet doit être temporairement suspendue pour toute intervention chirurgicale (à l'exception des interventions mineures non associées à un apport limité) de nourriture et de liquides) et ne doit pas être redémarré tant que la prise orale du patient n'a pas repris et que la fonction rénale n'a pas été évaluée comme Ordinaire.
Changement de l'état clinique des patients atteints de diabète de type 2 précédemment contrôlé
Un patient diabétique de type 2 précédemment bien contrôlé sous Janumet qui développe des anomalies de laboratoire ou des la maladie (en particulier la maladie vague et mal définie) doit être évaluée rapidement pour détecter des signes d'acidocétose ou de acidose. L'évaluation devrait inclure les électrolytes et les cétones sériques, la glycémie et, si indiqué, le pH sanguin, les niveaux de lactate, de pyruvate et de metformine. En cas d'acidose de l'une ou l'autre forme, Janumet doit être arrêté immédiatement et d'autres mesures correctives appropriées doivent être mises en place.
Utilisation avec des médicaments connus pour provoquer une hypoglycémie
Sitagliptine
Comme c'est généralement le cas avec d'autres antihyperglycémiants utilisés en association avec une sulfonylurée, lorsque la sitagliptine était utilisée en association avec la metformine et un sulfonylurée, un médicament connu pour provoquer une hypoglycémie, l'incidence de l'hypoglycémie a été supérieure à celle du placebo en association avec la metformine et un sulfonylurée [voir Effets indésirables]. Par conséquent, les patients recevant également un sécrétagogue d'insuline (par exemple, sulfonylurée, méglitinide) peuvent nécessiter une dose plus faible du sécrétagogue d'insuline pour réduire le risque d'hypoglycémie [voir Dosage et administration].
Chlorhydrate de metformine
L'hypoglycémie ne se produit pas chez les patients recevant la metformine seule dans les circonstances habituelles d'utilisation, mais peut survenir lorsque l'apport calorique est déficient, lorsque l'exercice intense n'est pas compensé par une supplémentation calorique ou lors d'une utilisation concomitante avec d'autres hypoglycémiants (tels que les sulfonylurées et l'insuline) ou l'éthanol. Les patients âgés, affaiblis ou mal nourris et ceux souffrant d'insuffisance surrénalienne ou hypophysaire ou d'intoxication alcoolique sont particulièrement sensibles aux effets hypoglycémiques. L'hypoglycémie peut être difficile à reconnaître chez les personnes âgées et chez les personnes qui prennent des médicaments bloquants β-adrénergiques.
Médicaments concomitants affectant la fonction rénale ou l'élimination de la metformine
Médicament (s) concomitant (s) pouvant affecter la fonction rénale ou entraîner un changement hémodynamique important ou interférer avec l'élimination de la metformine, comme les médicaments cationiques qui sont éliminés par la sécrétion tubulaire rénale [voir Interactions médicamenteuses], doit être utilisé avec prudence.
Études radiologiques avec des matériaux de contraste iodés intravasculaires
Études de contraste intravasculaire avec des matériaux iodés (par exemple, urogramme intraveineux, cholangiographie intraveineuse, angiographie et tomodensitométrie (TDM)) avec des produits de contraste intravasculaires) peuvent entraîner une altération aiguë de la fonction rénale et ont été associés à une acidose lactique chez les patients recevant de la metformine [voir Contre-indications]. Par conséquent, chez les patients chez qui une telle étude est prévue, Janumet doit être temporairement interrompu au moment ou avant la procédure et retenu pendant 48 heures après la procédure et réinstauré seulement après que la fonction rénale a été réévaluée et trouvée être normal.
États hypoxiques
Collapsus cardiovasculaire (choc) quelle qu'en soit la cause, insuffisance cardiaque congestive aiguë, infarctus aigu du myocarde et d'autres conditions caractérisées par une hypoxémie ont été associées à une acidose lactique et peuvent également provoquer une azotémie. Lorsque de tels événements se produisent chez des patients traités par Janumet, le médicament doit être rapidement arrêté.
Perte de contrôle de la glycémie
Lorsqu'un patient stabilisé sous un régime diabétique est exposé à un stress tel que fièvre, traumatisme, infection ou chirurgie, une perte temporaire de contrôle glycémique peut survenir. À ces moments, il peut être nécessaire de suspendre Janumet et d'administrer temporairement l'insuline. Janumet peut être rétabli une fois l'épisode aigu résolu.
Réactions d'hypersensibilité
Il y a eu des rapports post-commercialisation de réactions d'hypersensibilité graves chez des patients traités par la sitagliptine, l'un des composants de Janumet. Ces réactions comprennent l'anaphylaxie, l'œdème de Quincke et les affections cutanées exfoliatives, y compris le syndrome de Stevens-Johnson. Parce que ces réactions sont signalées volontairement par une population de taille incertaine, il est généralement impossible d'estimer de manière fiable leur fréquence ou d'établir une relation de cause à effet avec l'exposition au médicament. Le début de ces réactions est survenu dans les 3 premiers mois après le début du traitement par la sitagliptine, certains rapports survenant après la première dose. Si une réaction d'hypersensibilité est suspectée, arrêtez Janumet, évaluez les autres causes potentielles de l'événement et instaurez un traitement alternatif pour le diabète. [Voir Effets indésirables.]
Résultats macrovasculaires
Il n'y a eu aucune étude clinique établissant des preuves concluantes de réduction du risque macrovasculaire avec Janumet ou tout autre médicament antidiabétique.
Haut
Effets indésirables
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d’effets indésirables observés dans les essais cliniques médicament ne peut être directement comparé aux taux des essais cliniques d'un autre médicament et peut ne pas refléter les taux entraine toi.
Co-administration de sitagliptine et de metformine chez les patients atteints de diabète de type 2 mal contrôlés en matière d'alimentation et d'exercice
Le tableau 1 résume les effets indésirables les plus courants (5% des patients) signalés (quelle que soit l'évaluation de la causalité par l'investigateur) sur une période de 24 semaines. étude factorielle contrôlée contre placebo dans laquelle la sitagliptine et la metformine ont été co-administrées à des patients atteints de diabète de type 2 insuffisamment contrôlés au régime et l'exercice.
Tableau 1: Sitagliptine et metformine co-administrées aux patients atteints de diabète de type 2 mal contrôlés en matière d'alimentation et d'exercice: effets indésirables Rapporté (indépendamment de l'évaluation de la causalité par l'investigateur) chez 5% des patients recevant une thérapie combinée (et plus que chez les patients recevant Placebo)*
| Nombre de patients (%) | ||||
Placebo |
Sitagliptine 100 mg QD |
Metformine 500 mg / Metformine 1000 mg bid†|
Sitagliptine 50 mg bid + Metformine 500 mg / Metformine 1000 mg bid†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| La diarrhée | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Infection des voies respiratoires supérieures | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Mal de crâne | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Traitement complémentaire à la sitagliptine chez les patients atteints de diabète de type 2 insuffisamment contrôlé par la metformine seule
Dans un essai contrôlé par placebo de 24 semaines sur 100 mg de sitagliptine administrée une fois par jour à un régime de metformine deux fois par jour, effets indésirables rapportés indépendamment de l'évaluation de la causalité par l'investigateur chez 5% des patients et plus fréquemment que chez les patients ayant reçu placebo. L'arrêt du traitement en raison d'effets indésirables cliniques était similaire à celui du groupe placebo (sitagliptine et metformine, 1,9%; placebo et metformine, 2,5%).
Hypoglycémie
Les effets indésirables de l'hypoglycémie étaient basés sur tous les rapports d'hypoglycémie; une mesure concomitante du glucose n'était pas nécessaire. L'incidence globale des effets indésirables pré-spécifiés d'hypoglycémie chez les patients diabétiques de type 2 insuffisamment contrôlés par l'alimentation et l'exercice était de 0,6% patients sous placebo, 0,6% chez les patients sous sitagliptine seule, 0,8% chez les patients sous metformine seule et 1,6% chez les patients sous sitagliptine en association avec metformine. Chez les patients atteints de diabète de type 2 insuffisamment contrôlés par la metformine seule, l'incidence globale des les réactions d'hypoglycémie étaient de 1,3% chez les patients ayant reçu un complément de sitagliptine et de 2,1% chez les patients ayant reçu un complément placebo.
Effets indésirables gastro-intestinaux
Les incidences des effets indésirables gastro-intestinaux présélectionnés chez les patients traités par la sitagliptine et la metformine étaient similaires à celles rapportées pour les patients traités par la metformine seule. Voir tableau 2.
Tableau 2: Effets indésirables gastro-intestinaux présélectionnés (quelle que soit l'évaluation de la causalité par l'investigateur) signalés chez des patients atteints de diabète de type 2 recevant de la sitagliptine et de la metformine.
| Nombre de patients (%) | ||||||
| Étude de la sitagliptine et de la metformine chez des patients insuffisamment contrôlés sur l'alimentation et l'exercice |
Étude de l'adjonction de sitagliptine chez des patients insuffisamment contrôlés par la metformine seule | |||||
Placebo |
Sitagliptine 100 mg QD |
Metformine 500 mg / Metformine 1000 mg bid* |
Sitagliptine 50 mg bid + Metformine 500 mg / Metformine 1000 mg bid* |
Placebo et metformine â ‰ ¥ 1500 mg par jour |
Sitagliptine 100 mg QD et metformine â ‰ ¥ 1500 mg par jour |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| La diarrhée | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| La nausée | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Vomissement | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Douleur abdominale†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptine en association avec la metformine et le glimépiride
Dans une étude contrôlée par placebo de 24 semaines sur 100 mg de sitagliptine comme traitement d'appoint chez des patients atteints de diabète de type 2 insuffisamment contrôlés par la metformine et le glimépiride (sitagliptine, N = 116; placebo, N = 113), les effets indésirables rapportés quelle que soit l'évaluation de la causalité par l'investigateur chez 5% des patients traités par la sitagliptine et plus fréquemment que chez les patients traités par placebo étaient: hypoglycémie (sitagliptine, 16,4%; placebo, 0,9%) et maux de tête (6,9%, 2,7%).
Aucun changement cliniquement significatif des signes vitaux ou de l'ECG (y compris dans l'intervalle QTc) n'a été observé avec l'association de la sitagliptine et de la metformine.
L'expérience indésirable la plus courante en monothérapie à la sitagliptine signalée quel que soit l'investigateur une évaluation de la causalité chez 5% des patients et plus fréquemment que chez les patients sous placebo a été rhinopharyngite.
Les effets indésirables les plus courants (> 5%) établis en raison du début du traitement par la metformine sont la diarrhée, les nausées / vomissements, les flatulences, les malaises abdominaux, l'indigestion, l'asthénie et les maux de tête.
Tests de laboratoire
Sitagliptine
L'incidence des effets indésirables en laboratoire était similaire chez les patients traités par sitagliptine et metformine (7,6%) par rapport aux patients traités par placebo et metformine (8,7%). Dans la plupart des études, mais pas toutes, une légère augmentation du nombre de globules blancs (différence d'environ 200 cellules / microL de WBC par rapport au placebo; WBC de base moyenne d'environ 6600 cellules / microL) a été observée en raison d'une petite augmentation des neutrophiles. Cette modification des paramètres de laboratoire n'est pas considérée comme cliniquement pertinente.
Chlorhydrate de metformine
Dans les essais cliniques contrôlés de metformine d'une durée de 29 semaines, une diminution à des niveaux sous-normaux de vitamine B sérique auparavant normale12 des taux sans manifestations cliniques ont été observés chez environ 7% des patients. Cette diminution, peut-être due à une interférence avec B12 absorption du B12complexe de facteurs intrinsèques, est cependant très rarement associé à l'anémie et semble être rapidement réversible avec l'arrêt de la metformine ou de la vitamine B12 supplémentation. [Voir Avertissements et precautions.]
Expérience post-commercialisation
Les effets indésirables supplémentaires suivants ont été identifiés lors de l'utilisation après approbation de Janumet ou de la sitagliptine, l'un des composants de Janumet. Parce que ces réactions sont signalées volontairement par une population de taille incertaine, il est généralement impossible d'estimer de manière fiable leur fréquence ou d'établir une relation de cause à effet avec l'exposition au médicament.
Les réactions d'hypersensibilité comprennent l'anaphylaxie, l'œdème de Quincke, l'éruption cutanée, l'urticaire, la vascularite cutanée et les affections cutanées exfoliatives, y compris le syndrome de Stevens-Johnson [voir Avertissements et precautions]; infection des voies respiratoires supérieures; élévations des enzymes hépatiques; pancréatite.
Haut
Interactions médicamenteuses
Médicaments cationiques
Médicaments cationiques (p. Ex. Amiloride, digoxine, morphine, procaïnamide, quinidine, quinine, ranitidine, triamtérène, triméthoprime ou vancomycine) qui sont éliminés par la sécrétion tubulaire rénale ont théoriquement le potentiel d'interaction avec la metformine en rivalisant pour le transport tubulaire rénal commun systèmes. Une telle interaction entre la metformine et la cimétidine orale a été observée chez des volontaires sains normaux à la fois en dose unique et en doses multiples de metformine-cimétidine. études d'interactions médicamenteuses, avec une augmentation de 60% des concentrations plasmatiques maximales de metformine et de sang total et une augmentation de 40% des concentrations plasmatiques et de metformine dans le sang total AUC. Il n'y a eu aucun changement dans la demi-vie d'élimination dans l'étude à dose unique. La metformine n'a eu aucun effet sur la pharmacocinétique de la cimétidine. Bien que ces interactions restent théoriques (sauf pour la cimétidine), une surveillance attentive du patient et un ajustement de la dose de Janumet et / ou médicament interférant est recommandé chez les patients qui prennent des médicaments cationiques qui sont excrétés via la sécrétion tubulaire rénale proximale système.
Digoxine
Il y avait une légère augmentation de la zone sous la courbe (ASC, 11%) et la concentration moyenne maximale de médicament (Cmax, 18%) de digoxine avec la co-administration de 100 mg de sitagliptine pendant 10 jours. Ces augmentations ne sont pas considérées comme susceptibles d'être cliniquement significatives. La digoxine, en tant que médicament cationique, a le potentiel de rivaliser avec la metformine pour les systèmes de transport tubulaire rénal courants, affectant ainsi les concentrations sériques de la digoxine, de la metformine ou des deux. Les patients recevant de la digoxine doivent être surveillés de manière appropriée. Aucun ajustement posologique de la digoxine ou de Janumet n'est recommandé.
Glyburide
Dans une étude d'interaction à dose unique chez des patients diabétiques de type 2, la co-administration de metformine et de glyburide n'a entraîné aucune modification de la pharmacocinétique ou de la pharmacodynamique de la metformine. Baisse de l'AUC et du C du glyburidemax ont été observés, mais étaient très variables. La nature à dose unique de cette étude et le manque de corrélation entre les taux sanguins de glyburide et les effets pharmacodynamiques rendent la signification clinique de cette interaction incertaine.
Furosémide
Une étude d'interaction médicamenteuse metformine-furosémide à dose unique chez des sujets sains a démontré que les paramètres pharmacocinétiques des deux composés étaient affectés par la co-administration. Le furosémide a augmenté le plasma de metformine et le C sanguinmax de 22% et l'ASC sanguine de 15%, sans modification significative de la clairance rénale de la metformine. Lorsqu'il est administré avec de la metformine, le Cmax et l'ASC du furosémide étaient respectivement 31% et 12% inférieurs à ceux administrés seuls, et la demi-vie terminale a été diminuée de 32%, sans aucun changement significatif du furosémide rénal dégagement. Aucune information n'est disponible sur l'interaction de la metformine et du furosémide lorsqu'ils sont co-administrés de façon chronique.
Nifedipine
Une étude d'interaction médicamenteuse metformine-nifédipine à dose unique chez des volontaires sains normaux a démontré que la co-administration de nifédipine augmentait la metformine C plasmatique.max et l'ASC de 20% et 9%, respectivement, et ont augmenté la quantité excrétée dans l'urine. Tmax et la demi-vie n'a pas été affectée. La nifédipine semble augmenter l'absorption de la metformine. La metformine a eu des effets minimes sur la nifédipine.
L'utilisation de la metformine avec d'autres médicaments
Certains médicaments ont tendance à produire une hyperglycémie et peuvent entraîner une perte de contrôle glycémique. Ces médicaments comprennent les thiazides et autres diurétiques, les corticostéroïdes, les phénothiazines, les produits thyroïdiens, œstrogènes, contraceptifs oraux, phénytoïne, acide nicotinique, sympathomimétiques, médicaments bloquant les canaux calciques et isoniazide. Lorsque de tels médicaments sont administrés à un patient recevant Janumet, le patient doit être étroitement surveillé afin de maintenir un contrôle glycémique adéquat.
Chez des volontaires sains, la pharmacocinétique de la metformine et du propranolol, de la metformine et de l'ibuprofène n'a pas été modifiée lors de la co-administration dans des études d'interaction à dose unique.
La metformine est liée de manière négligeable aux protéines plasmatiques et est donc moins susceptible d'interagir avec des médicaments hautement liés aux protéines tels que salicylates, sulfonamides, chloramphénicol et probénécide, par rapport aux sulfonylurées, qui sont fortement liées au sérum protéines.
Haut
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B:
Janumet
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes avec Janumet ou ses composants individuels; par conséquent, l'innocuité de Janumet chez la femme enceinte n'est pas connue. Janumet ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Merck & Co., Inc. tient un registre pour surveiller les résultats de la grossesse des femmes exposées à Janumet pendant la grossesse. Les fournisseurs de soins de santé sont encouragés à signaler toute exposition prénatale à Janumet en appelant le Registre des grossesses au (800) 986-8999.
Aucune étude animale n'a été menée avec les produits combinés dans Janumet pour évaluer les effets sur la reproduction. Les données suivantes sont basées sur les résultats d'études réalisées avec la sitagliptine ou la metformine individuellement.
Sitagliptine
Des études de reproduction ont été réalisées chez le rat et le lapin. Des doses de sitagliptine allant jusqu'à 125 mg / kg (environ 12 fois l'exposition humaine à la dose humaine maximale recommandée) n'ont pas altéré la fertilité ni endommagé le fœtus. Il n'y a cependant aucune étude adéquate et bien contrôlée avec la sitagliptine chez la femme enceinte.
La sitagliptine administrée à des rates et à des lapines gravides du 6e au 20e jour de gestation (organogenèse) n'était pas tératogène à des doses orales allant jusqu'à 250 mg / kg (rats) et 125 mg / kg (lapins), soit environ 30 et 20 fois l'exposition humaine à la dose humaine maximale recommandée (MRHD) de 100 mg / jour sur la base de l'ASC comparaisons. Des doses plus élevées ont augmenté l'incidence de malformations des côtes chez la progéniture à 1 000 mg / kg, soit environ 100 fois l'exposition humaine au MRHD.
La sitagliptine administrée à des rats femelles du 6e jour de gestation au 21e jour de lactation a diminué le poids corporel de la progéniture mâle et femelle à 1000 mg / kg. Aucune toxicité fonctionnelle ou comportementale n'a été observée chez la progéniture des rats.
Le transfert placentaire de sitagliptine administrée à des rates gravides était d'environ 45% à 2 heures et 80% à 24 heures après l'administration. Le transfert placentaire de sitagliptine administrée à des lapines gravides était d'environ 66% à 2 heures et 30% à 24 heures.
Chlorhydrate de metformine
La metformine n'a pas été tératogène chez le rat et le lapin à des doses allant jusqu'à 600 mg / kg / jour. Cela représente une exposition d'environ 2 et 6 fois la dose quotidienne maximale recommandée pour l'homme de 2 000 mg, basée sur des comparaisons de la surface corporelle pour les rats et les lapins, respectivement. La détermination des concentrations fœtales a démontré une barrière placentaire partielle à la metformine.
Mères allaitantes
Aucune étude n'a été menée chez des animaux en lactation avec les composants combinés de Janumet. Dans les études réalisées avec les composants individuels, la sitagliptine et la metformine sont sécrétées dans le lait des rates allaitantes. On ne sait pas si la sitagliptine est excrétée dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, il convient d'être prudent lorsque Janumet est administré à une femme qui allaite.
Utilisation pédiatrique
La sécurité et l'efficacité de Janumet chez les patients pédiatriques de moins de 18 ans n'ont pas été établies.
Utilisation gériatrique
Janumet
Étant donné que la sitagliptine et la metformine sont largement excrétées par les reins et que le vieillissement peut être associé à une fonction rénale réduite, Janumet doit être utilisé avec prudence à mesure que l'âge augmente. La sélection des doses doit être prudente et doit être basée sur une surveillance attentive et régulière de la fonction rénale. [Voir Avertissements et precautions; Pharmacologie clinique.]
Sitagliptine
Sur le nombre total de sujets (N = 3884) dans les études cliniques de phase II et III sur la sitagliptine, 725 patients étaient âgés de 65 ans et plus, tandis que 61 patients étaient âgés de 75 ans et plus. Aucune différence globale de sécurité ou d'efficacité n'a été observée entre les sujets de 65 ans et plus et les sujets plus jeunes. Bien que cette expérience clinique et d'autres signalées n'aient pas identifié de différences dans les réponses entre les patients âgés et les jeunes, une plus grande sensibilité de certaines personnes âgées ne peut être exclu.
Chlorhydrate de metformine
Les études cliniques contrôlées de la metformine n'ont pas inclus un nombre suffisant de patients âgés pour déterminer s'ils répondent différemment de patients plus jeunes, bien que d'autres expériences cliniques rapportées n'aient pas identifié de différences de réponses entre les personnes âgées et les jeunes les patients. La metformine ne doit être utilisée que chez les patients dont la fonction rénale est normale. La posologie initiale et d'entretien de la metformine doit être prudente chez les patients à un âge avancé, en raison du potentiel de diminution de la fonction rénale dans cette population. Tout ajustement posologique doit être basé sur une évaluation minutieuse de la fonction rénale. [Voir Contre-indications; Avertissements et precautions; et Pharmacologie clinique.]
Haut
Surdosage
Sitagliptine
Au cours des essais cliniques contrôlés chez des sujets sains, des doses uniques allant jusqu'à 800 mg de sitagliptine ont été administrées. Des augmentations moyennes maximales du QTc de 8,0 ms ont été observées dans une étude à une dose de 800 mg de sitagliptine, un effet moyen qui n'est pas considéré comme cliniquement important [voir Pharmacologie clinique]. Il n'y a aucune expérience avec des doses supérieures à 800 mg chez l'homme. Dans les études à doses multiples de phase I, aucun effet indésirable clinique lié à la dose n'a été observé avec la sitagliptine à des doses allant jusqu'à 400 mg par jour pendant des périodes allant jusqu'à 28 jours.
En cas de surdosage, il est raisonnable d'employer les mesures de soutien habituelles, par exemple, retirer le matériel non absorbé du tube digestif des voies respiratoires, recourir à une surveillance clinique (y compris l'obtention d'un électrocardiogramme) et instaurer un traitement de soutien tel qu'indiqué par statut.
La sitagliptine est modérément dialysable. Dans les études cliniques, environ 13,5% de la dose a été supprimée au cours d'une séance d'hémodialyse de 3 à 4 heures. Une hémodialyse prolongée peut être envisagée si cela est cliniquement approprié. On ne sait pas si la sitagliptine est dialysable par dialyse péritonéale.
Chlorhydrate de metformine
Un surdosage de chlorhydrate de metformine s'est produit, y compris l'ingestion de quantités supérieures à 50 grammes. Une hypoglycémie a été rapportée dans environ 10% des cas, mais aucune association causale avec le chlorhydrate de metformine n'a été établie. Une acidose lactique a été rapportée dans environ 32% des cas de surdosage de metformine [voir Avertissements et precautions]. La metformine est dialysable avec une clairance pouvant atteindre 170 ml / min dans de bonnes conditions hémodynamiques. Par conséquent, l'hémodialyse peut être utile pour éliminer le médicament accumulé chez les patients chez lesquels un surdosage de metformine est suspecté.
Haut
La description
Les comprimés de Janumet (sitagliptine / metformine HCl) contiennent deux antihyperglycémiants oraux utilisés dans la gestion du diabète de type 2: la sitagliptine et le chlorhydrate de metformine.
Sitagliptine
La sitagliptine est un inhibiteur oralement actif de l'enzyme dipeptidyl peptidase-4 (DPP-4). La sitagliptine est présente dans les comprimés de Janumet sous forme de phosphate de sitagliptine monohydraté. Le phosphate de sitagliptine monohydraté est décrit chimiquement comme 7 - [(3R) - 3 - amino - 1 - oxo - 4 - (2,4,5 - trifluorophényl) butyl] - 5,6,7,8 - tétrahydro - 3 - (trifluorométhyl) - 1,2,4 - triazolo [4,3 - a] pyrazine phosphate (1: 1) monohydraté avec une formule empirique de C16H15F6N5OH3PO4-H2O et un poids moléculaire de 523,32. La formule structurelle est:
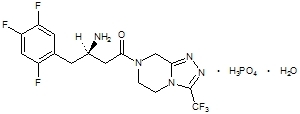
Le phosphate de sitagliptine monohydraté est une poudre cristalline non hygroscopique blanche à blanc cassé. Il est soluble dans l'eau et le N, N-diméthyl formamide; légèrement soluble dans le méthanol; très légèrement soluble dans l'éthanol, l'acétone et l'acétonitrile; et insoluble dans l'isopropanol et l'acétate d'isopropyle.
Chlorhydrate de metformine
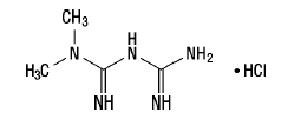
Le chlorhydrate de metformine (chlorhydrate de diamide N, N-diméthylimidodicarbonimidique) n'est chimiquement ou pharmacologiquement lié à aucune autre classe d'agents antihyperglycémiques oraux. Le chlorhydrate de metformine est un composé cristallin blanc à blanc cassé dont la formule moléculaire est C4H11N5-HCl et un poids moléculaire de 165,63. Le chlorhydrate de metformine est librement soluble dans l'eau et est pratiquement insoluble dans l'acétone, l'éther et le chloroforme. Le pKune de la metformine est de 12,4. Le pH d'une solution aqueuse à 1% de chlorhydrate de metformine est de 6,68. La formule structurelle est la suivante:
Janumet
Janumet est disponible pour une administration orale sous forme de comprimés contenant 64,25 mg de phosphate de sitagliptine monohydraté et équivalent de chlorhydrate de metformine à: 50 mg de sitagliptine sous forme de base libre et 500 mg de chlorhydrate de metformine (Janumet 50 mg / 500 mg) ou 1000 mg de chlorhydrate de metformine (Janumet 50 mg / 1000 mg). Chaque comprimé pelliculé de Janumet contient les ingrédients inactifs suivants: cellulose microcristalline, polyvinylpyrrolidone, laurylsulfate de sodium et stéaryl fumarate de sodium. De plus, le film pelliculé contient les ingrédients inactifs suivants: alcool polyvinylique, polyéthylène glycol, talc, dioxyde de titane, oxyde de fer rouge et oxyde de fer noir.
Haut
Pharmacologie clinique
Mécanisme d'action
Janumet
Janumet associe deux antihyperglycémiants à des mécanismes d'action complémentaires pour améliorer le contrôle glycémique chez les patients atteints de diabète de type 2: sitagliptine, un inhibiteur de la dipeptidyl peptidase-4 (DPP-4) et le chlorhydrate de metformine, un membre du biguanide classe.
Sitagliptine
La sitagliptine est un inhibiteur de la DPP-4, qui exercerait ses effets chez les patients atteints de diabète de type 2 en ralentissant l'inactivation des hormones incrétines. Les concentrations des hormones actives intactes sont augmentées par la sitagliptine, augmentant et prolongeant ainsi l'action de ces hormones. Hormones incrétines, y compris le glucagon-like peptide-1 (GLP-1) et le glucose insulinotrope dépendant polypeptide (GIP), sont libérés par l'intestin tout au long de la journée, et les niveaux sont augmentés en réponse à un repas. Ces hormones sont rapidement inactivées par l'enzyme DPP-4. Les incrétines font partie d'un système endogène impliqué dans la régulation physiologique de l'homéostasie du glucose. Lorsque les concentrations de glucose dans le sang sont normales ou élevées, le GLP-1 et le GIP augmentent la synthèse d'insuline et la libération des cellules bêta pancréatiques par des voies de signalisation intracellulaires impliquant l'AMP cyclique. Le GLP-1 réduit également la sécrétion de glucagon à partir des cellules alpha pancréatiques, entraînant une réduction de la production hépatique de glucose. En augmentant et en prolongeant les niveaux d'incrétine active, la sitagliptine augmente la libération d'insuline et diminue les niveaux de glucagon dans la circulation d'une manière dépendante du glucose. La sitagliptine démontre une sélectivité pour DPP-4 et n'inhibe pas l'activité de DPP-8 ou DPP-9 in vitro à des concentrations proches de celles des doses thérapeutiques.
Chlorhydrate de metformine
La metformine est un agent antihyperglycémiant qui améliore la tolérance au glucose chez les patients atteints de diabète de type 2, abaissant la glycémie basale et postprandiale. Ses mécanismes d'action pharmacologiques sont différents des autres classes d'agents antihyperglycémiques oraux. La metformine diminue la production hépatique de glucose, diminue l'absorption intestinale de glucose et améliore la sensibilité à l'insuline en augmentant l'absorption et l'utilisation périphériques du glucose. Contrairement aux sulfonylurées, la metformine ne produit pas d'hypoglycémie ni chez les patients atteints de diabète de type 2 ni chez les sujets normaux (sauf dans des circonstances spéciales [voir Avertissements et precautions]) et ne provoque pas d'hyperinsulinémie. Avec la metformine, la sécrétion d'insuline reste inchangée tandis que les taux d'insuline à jeun et la réponse plasmatique à l'insuline toute la journée peuvent en fait diminuer.
12.2 Pharmacodynamique
Sitagliptine
Général
Chez les patients atteints de diabète de type 2, l'administration de sitagliptine a entraîné une inhibition de l'activité enzymatique DPP-4 pendant une période de 24 heures. Après une charge de glucose par voie orale ou un repas, cette inhibition de la DPP-4 a entraîné une augmentation de 2 à 3 fois des niveaux circulants de GLP-1 et de GIP actifs, diminution des concentrations de glucagon et augmentation de la réactivité de la libération d'insuline au glucose, entraînant une augmentation du peptide C et de l'insuline concentrations. L'augmentation de l'insuline avec la diminution du glucagon a été associée à des concentrations de glucose à jeun plus faibles et à une excursion de glucose réduite après une charge de glucose par voie orale ou un repas.
Co-administration de sitagliptine et de chlorhydrate de metformine
Dans une étude de deux jours chez des sujets sains, la sitagliptine seule a augmenté les concentrations actives de GLP-1, tandis que la metformine seule a augmenté les concentrations actives et totales de GLP-1 à des niveaux similaires. La co-administration de sitagliptine et de metformine a eu un effet additif sur les concentrations actives de GLP-1. La sitagliptine, mais pas la metformine, a augmenté les concentrations actives de GIP. On ne sait pas ce que ces résultats signifient pour les changements de contrôle glycémique chez les patients atteints de diabète de type 2.
Dans les études menées auprès de sujets sains, la sitagliptine n'a pas abaissé la glycémie ni provoqué d'hypoglycémie.
Électrophysiologie cardiaque
Dans une étude croisée randomisée et contrôlée contre placebo, 79 sujets sains ont reçu une dose orale unique de 100 mg de sitagliptine, 800 mg de sitagliptine (8 fois la dose recommandée) et un placebo. À la dose recommandée de 100 mg, il n'y a eu aucun effet sur l'intervalle QTc obtenu au pic de concentration plasmatique ou à tout autre moment de l'étude. Après la dose de 800 mg, l'augmentation maximale de la variation moyenne corrigée par placebo du QTc par rapport au départ à 3 heures après l'administration était de 8,0 ms. Cette augmentation n'est pas considérée comme cliniquement significative. À la dose de 800 mg, les concentrations plasmatiques maximales de sitagliptine étaient environ 11 fois plus élevées que les concentrations maximales après une dose de 100 mg.
Chez les patients diabétiques de type 2 ayant reçu 100 mg de sitagliptine (N = 81) ou 200 mg de sitagliptine (N = 63), aucun changement significatif de l'intervalle QTc d'après les données ECG obtenues au moment du pic plasmatique attendu concentration.
Pharmacocinétique
Janumet
Les résultats d'une étude de bioéquivalence chez des sujets sains ont démontré que le Janumet (sitagliptine / metformine HCl) 50 mg / 500 Les comprimés combinés de mg et de 50 mg / 1000 mg sont bioéquivalents à la co-administration de doses correspondantes de sitagliptine (JANUVIA™2) et le chlorhydrate de metformine sous forme de comprimés individuels.
Absorption
Sitagliptine
La biodisponibilité absolue de la sitagliptine est d'environ 87%. La co-administration d'un repas riche en graisses avec la sitagliptine n'a eu aucun effet sur la pharmacocinétique de la sitagliptine.
Chlorhydrate de metformine
La biodisponibilité absolue d'un comprimé de 500 mg de chlorhydrate de metformine administré à jeun est d'environ 50 à 60%. Des études utilisant des doses orales uniques de comprimés de chlorhydrate de metformine de 500 mg à 1500 mg et de 850 mg à 2550 mg indiquent qu'il y a un manque de proportionnalité de la dose avec l'augmentation des doses, qui est dû à une diminution de l'absorption plutôt qu'à une altération de l'élimination. Les aliments diminuent l'étendue de la metformine et la retardent légèrement, comme le montre une concentration plasmatique maximale moyenne d'environ 40% inférieure (Cmax), une zone inférieure de 25% sous la courbe de la concentration plasmatique en fonction du temps (ASC) et une prolongation de 35 minutes du temps nécessaire pour atteindre la concentration plasmatique maximale (Tmax) après l'administration d'un seul comprimé de 850 mg de metformine avec de la nourriture, par rapport au même comprimé administré à jeun. La pertinence clinique de ces diminutions est inconnue.
Distribution
Sitagliptine
Le volume moyen de distribution à l'état d'équilibre après une dose intraveineuse unique de 100 mg de sitagliptine à des sujets sains est d'environ 198 litres. La fraction de sitagliptine liée de manière réversible aux protéines plasmatiques est faible (38%).
Chlorhydrate de metformine
Le volume apparent de distribution (V / F) de metformine après des doses orales uniques de comprimés de chlorhydrate de metformine 850 mg était en moyenne de 654 ± 358 L. La metformine est liée de manière négligeable aux protéines plasmatiques, contrairement aux sulfonylurées, qui sont liées à plus de 90% aux protéines. La metformine se répartit en érythrocytes, très probablement en fonction du temps. Aux doses cliniques habituelles et aux schémas posologiques des comprimés de chlorhydrate de metformine, les concentrations plasmatiques à l'équilibre de la metformine sont atteintes en 24 à 48 heures et sont généralement
Métabolisme
Sitagliptine
Environ 79% de la sitagliptine est excrétée sous forme inchangée dans l'urine, le métabolisme étant une voie d'élimination mineure.
Après un [14C] sitagliptine par voie orale, environ 16% de la radioactivité a été excrétée sous forme de métabolites de la sitagliptine. Six métabolites ont été détectés à l'état de traces et ne devraient pas contribuer à l'activité inhibitrice de la DPP-4 plasmatique de la sitagliptine. Des études in vitro ont indiqué que l'enzyme principale responsable du métabolisme limité de la sitagliptine était le CYP3A4, avec la contribution du CYP2C8.
Chlorhydrate de metformine
Des études intraveineuses à dose unique chez des sujets normaux démontrent que la metformine est excrétée urine et ne subit pas de métabolisme hépatique (aucun métabolite n'a été identifié chez l'homme) ni biliaire excrétion.
Excrétion
Sitagliptine
Après l'administration d'un oral [14C] la dose de sitagliptine à des sujets sains, environ 100% de la radioactivité administrée a été éliminée dans les fèces (13%) ou l'urine (87%) dans la semaine suivant l'administration. Le terminal apparent t1/2 après une dose orale de 100 mg de sitagliptine était d'environ 12,4 heures et la clairance rénale était d'environ 350 ml / min.
L'élimination de la sitagliptine se fait principalement par excrétion rénale et implique une sécrétion tubulaire active. La sitagliptine est un substrat du transporteur 3 d'anions organiques humains (hOAT-3), qui peut être impliqué dans l'élimination rénale de la sitagliptine. La pertinence clinique de hOAT-3 dans le transport de la sitagliptine n'a pas été établie. La sitagliptine est également un substrat de la p-glycoprotéine, qui peut également être impliquée dans la médiation de l'élimination rénale de la sitagliptine. Cependant, la cyclosporine, un inhibiteur de la glycoprotéine p, n'a pas réduit la clairance rénale de la sitagliptine.
Chlorhydrate de metformine
La clairance rénale est environ 3,5 fois supérieure à la clairance de la créatinine, ce qui indique que la sécrétion tubulaire est la principale voie d'élimination de la metformine. Après administration orale, environ 90% du médicament absorbé est éliminé par voie rénale dans les 24 premières heures, avec une demi-vie d'élimination plasmatique d'environ 6,2 heures. Dans le sang, la demi-vie d'élimination est d'environ 17,6 heures, ce qui suggère que la masse érythrocytaire peut être un compartiment de distribution.
Populations spéciales
Insuffisance rénale
Janumet
Janumet ne doit pas être utilisé chez les patients présentant une insuffisance rénale [voir Contre-indications; Avertissements et precautions].
Sitagliptine
Une augmentation d'environ 2 fois de l'ASC plasmatique de la sitagliptine a été observée chez les patients présentant une insuffisance rénale modérée, et une une augmentation a été observée chez les patients atteints d'insuffisance rénale sévère, y compris les patients atteints d'IRT à l'hémodialyse, par rapport au contrôle sain normal sujets.
Chlorhydrate de metformine
Chez les patients dont la fonction rénale est diminuée (sur la base de la clairance de la créatinine mesurée), la demi-vie plasmatique et sanguine de metformine est prolongée et la clairance rénale est diminuée proportionnellement à la diminution de la créatinine dégagement.
Insuffisance hépatique
Sitagliptine
Chez les patients présentant une insuffisance hépatique modérée (score de Child-Pugh 7 à 9), l'ASC et la C moyennesmax de la sitagliptine a augmenté d'environ 21% et 13%, respectivement, par rapport aux témoins appariés sains après l'administration d'une dose unique de 100 mg de sitagliptine. Ces différences ne sont pas considérées comme cliniquement significatives.
Il n'y a pas d'expérience clinique chez les patients présentant une insuffisance hépatique sévère (score Child-Pugh> 9).
Chlorhydrate de metformine
Aucune étude pharmacocinétique de la metformine n'a été menée chez les patients présentant une insuffisance hépatique.
Le sexe
Sitagliptine
Le sexe n'a eu aucun effet cliniquement significatif sur la pharmacocinétique de la sitagliptine sur la base d'un composite analyse des données pharmacocinétiques de phase I et sur une analyse pharmacocinétique de population des phases I et II Les données.
Chlorhydrate de metformine
Les paramètres pharmacocinétiques de la metformine ne différaient pas significativement entre les sujets normaux et les patients atteints de diabète de type 2 lorsqu'ils étaient analysés selon le sexe. De même, dans des études cliniques contrôlées chez des patients atteints de diabète de type 2, l'effet antihyperglycémiant de la metformine était comparable chez les hommes et les femmes.
Gériatrique
Sitagliptine
Lorsque les effets de l'âge sur la fonction rénale sont pris en compte, l'âge seul n'a pas de impact significatif sur la pharmacocinétique de la sitagliptine sur la base d'une pharmacocinétique de population une analyse. Les sujets âgés (65 à 80 ans) avaient des concentrations plasmatiques de sitagliptine environ 19% plus élevées que les sujets plus jeunes.
Chlorhydrate de metformine
Des données limitées provenant d'études pharmacocinétiques contrôlées sur la metformine chez des sujets âgés en bonne santé suggèrent que la clairance plasmatique totale de la metformine est diminuée, la demi-vie est prolongée et Cmax augmente par rapport aux sujets jeunes en bonne santé. D'après ces données, il apparaît que le changement de la pharmacocinétique de la metformine avec le vieillissement est principalement dû à un changement de la fonction rénale (voir GLUCOPHAGE3 prescrire des informations: PHARMACOLOGIE CLINIQUE, Populations spéciales, Gériatrie).
Le traitement par Janumet ne doit pas être instauré chez les patients âgés de 80 ans ou moins à moins que la mesure de la clairance de la créatinine ne démontre que la fonction rénale n'est pas réduite [voir Avertissements et precautions].
Pédiatrique
Aucune étude avec Janumet n'a été réalisée chez les patients pédiatriques.
Course
Sitagliptine
La race n'a eu aucun effet cliniquement significatif sur la pharmacocinétique de la sitagliptine sur la base d'une analyse composite des données pharmacocinétiques disponibles, y compris les sujets blancs, hispaniques, noirs, asiatiques et autres races groupes.
Chlorhydrate de metformine
Aucune étude des paramètres pharmacocinétiques de la metformine selon la race n'a été réalisée. Dans des études cliniques contrôlées sur la metformine chez des patients atteints de diabète de type 2, l'effet antihyperglycémiant était comparable chez les blancs (n = 249), les noirs (n = 51) et les hispaniques (n = 24).
Indice de masse corporelle (IMC)
Sitagliptine
L'indice de masse corporelle n'a eu aucun effet cliniquement significatif sur la pharmacocinétique de la sitagliptine sur la base d'un composite analyse des données pharmacocinétiques de phase I et sur une analyse pharmacocinétique de population des phases I et II Les données.
Interactions médicamenteuses
Sitagliptine et chlorhydrate de metformine
La co-administration de doses multiples de sitagliptine (50 mg) et de metformine (1000 mg) administrée deux fois ne modifie pas de façon significative la pharmacocinétique de la sitagliptine ou de la metformine chez les patients de type 2 Diabète.
Aucune étude d’interaction pharmacocinétique avec Janumet n’a été réalisée; cependant, de telles études ont été menées avec les composants individuels de Janumet (sitagliptine et chlorhydrate de metformine).
Sitagliptine
Évaluation in vitro des interactions médicamenteuses
La sitagliptine n'est pas un inhibiteur des isoenzymes CYP CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 ou 2B6 et n'est pas un inducteur du CYP3A4. La sitagliptine est un substrat de la glycoprotéine p, mais n'inhibe pas le transport médié par la glycoprotéine p de la digoxine. Sur la base de ces résultats, la sitagliptine est considérée comme peu susceptible de provoquer des interactions avec d'autres médicaments qui utilisent ces voies.
La sitagliptine n'est pas fortement liée aux protéines plasmatiques. Par conséquent, la propension de la sitagliptine à être impliquée dans des interactions médicamenteuses cliniquement significatives médiées par un déplacement de liaison aux protéines plasmatiques est très faible.
Évaluation in vivo des interactions médicamenteuses
Effet de la sitagliptine sur d'autres médicaments
Dans les études cliniques, comme décrit ci-dessous, la sitagliptine n'a pas modifié de façon significative la pharmacocinétique de la metformine, du glyburide, de la simvastatine, de la rosiglitazone, de la warfarine ou orale contraceptifs, fournissant des preuves in vivo d'une faible propension à provoquer des interactions médicamenteuses avec des substrats de CYP3A4, CYP2C8, CYP2C9 et un transporteur cationique organique (OCT).
Digoxine: la sitagliptine a eu un effet minimal sur la pharmacocinétique de la digoxine. Après l'administration de 0,25 mg de digoxine en concomitance avec 100 mg de sitagliptine par jour pendant 10 jours, l'ASC plasmatique de la digoxine a augmenté de 11% et le C plasmatiquemax de 18%.
Sulfonylurées: La pharmacocinétique d'une dose unique de glyburide, un substrat du CYP2C9, n'a pas été significativement modifiée chez les sujets recevant plusieurs doses de sitagliptine. Aucune interaction cliniquement significative ne serait attendue avec d'autres sulfonylurées (par exemple, le glipizide, le tolbutamide et le glimépiride) qui, comme le glyburide, sont principalement éliminés par le CYP2C9 [voir Avertissements et precautions].
Simvastatine: La pharmacocinétique à dose unique de la simvastatine, un substrat du CYP3A4, n'a pas été significativement modifiée chez les sujets recevant plusieurs doses quotidiennes de sitagliptine. Par conséquent, la sitagliptine n'est pas un inhibiteur du métabolisme médié par le CYP3A4.
Thiazolidinediones: la pharmacocinétique d'une dose unique de rosiglitazone n'a pas été significativement modifiée chez les sujets recevoir plusieurs doses quotidiennes de sitagliptine, ce qui indique que la sitagliptine n'est pas un inhibiteur de la médiation par le CYP2C8 métabolisme.
Warfarine: plusieurs doses quotidiennes de sitagliptine n'ont pas modifié de façon significative la pharmacocinétique, comme Énantiomères de warfarine S (-) ou R (+), ou pharmacodynamique (telle qu'évaluée par la mesure de l'INR de la prothrombine) d'une dose unique de warfarine. Étant donné que la warfarine S (-) est principalement métabolisée par le CYP2C9, ces données corroborent également la conclusion selon laquelle la sitagliptine n'est pas un inhibiteur du CYP2C9.
Contraceptifs oraux: la co-administration avec la sitagliptine n'a pas modifié de façon significative la pharmacocinétique à l'état d'équilibre de la noréthindrone ou de l'éthinylestradiol.
Effet d'autres médicaments sur la sitagliptine
Les données cliniques décrites ci-dessous suggèrent que la sitagliptine n'est pas sensible aux interactions cliniquement significatives des médicaments co-administrés.
Cyclosporine: Une étude a été menée pour évaluer l'effet de la cyclosporine, un puissant inhibiteur de la glycoprotéine p, sur la pharmacocinétique de la sitagliptine. La co-administration d'une dose orale unique de 100 mg de sitagliptine et d'une dose orale unique de 600 mg de cyclosporine a augmenté l'ASC et la Cmax de la sitagliptine d'environ 29% et 68%, respectivement. Ces modifications modestes de la pharmacocinétique de la sitagliptine n'ont pas été jugées cliniquement significatives. La clairance rénale de la sitagliptine n'a pas non plus été modifiée de manière significative. Par conséquent, aucune interaction significative ne serait attendue avec d'autres inhibiteurs de la glycoprotéine p.
Chlorhydrate de metformine
[Voir Interactions médicamenteuses]
Haut
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Janumet
Aucune étude animale n'a été menée avec les produits combinés dans Janumet pour évaluer la cancérogenèse, la mutagenèse ou l'altération de la fertilité. Les données suivantes sont basées sur les résultats d'études réalisées avec la sitagliptine et la metformine individuellement.
Sitagliptine
Une étude de cancérogénicité de deux ans a été menée sur des rats mâles et femelles ayant reçu des doses orales de sitagliptine de 50, 150 et 500 mg / kg / jour. Il y avait une incidence accrue d'adénomes / carcinomes hépatiques combinés chez les hommes et les femmes et de carcinomes hépatiques chez les femmes à 500 mg / kg. Cette dose entraîne des expositions environ 60 fois l'exposition humaine à la dose quotidienne maximale recommandée chez l'homme adulte (MRHD) de 100 mg / jour, sur la base des comparaisons de l'ASC. Aucune tumeur hépatique n'a été observée à 150 mg / kg, soit environ 20 fois l'exposition humaine au MRHD. Une étude de cancérogénicité de deux ans a été menée sur des souris mâles et femelles ayant reçu des doses orales de sitagliptine de 50, 125, 250 et 500 mg / kg / jour. Il n'y a eu aucune augmentation de l'incidence des tumeurs dans aucun organe jusqu'à 500 mg / kg, environ 70 fois l'exposition humaine au MRHD. La sitagliptine n'était pas mutagène ni clastogène avec ou sans activation métabolique dans le test de mutagénicité bactérienne Ames, un ovaire de hamster chinois (CHO) essai d'aberration chromosomique, essai de cytogénétique in vitro dans CHO, essai d'élution alcalin d'ADN d'hépatocytes de rat in vitro et micronoyau in vivo essai.
Dans les études de fertilité chez le rat avec des doses de gavage oral de 125, 250 et 1000 mg / kg, les mâles ont été traités pendant 4 semaines avant l'accouplement, pendant l'accouplement, jusqu'à la fin prévue (environ 8 semaines au total), et les femelles ont été traitées 2 semaines avant l'accouplement pendant la gestation jour 7. Aucun effet indésirable sur la fertilité n'a été observé à 125 mg / kg (environ 12 fois l'exposition humaine à la MRHD de 100 mg / jour sur la base des comparaisons de l'ASC). À des doses plus élevées, une augmentation des résorptions non liées à la dose chez les femmes a été observée (environ 25 et 100 fois l'exposition humaine au MRHD d'après la comparaison de l'ASC).
Chlorhydrate de metformine
Des études de cancérogénicité à long terme ont été réalisées chez le rat (durée d'administration de 104 semaines) et la souris (durée d'administration de 91 semaines) à des doses pouvant atteindre 900 mg / kg / jour et 1500 mg / kg / jour, respectivement. Ces doses représentent à la fois environ quatre fois la dose quotidienne maximale recommandée pour l'homme de 2 000 mg, d'après les comparaisons de la surface corporelle. Aucune preuve de cancérogénicité avec la metformine n'a été trouvée chez les souris mâles ou femelles. De même, aucun potentiel tumorigène n'a été observé avec la metformine chez le rat mâle. Il y avait cependant une incidence accrue de polypes utérins stromaux bénins chez les rats femelles traités avec 900 mg / kg / jour.
Il n'y avait aucune preuve d'un potentiel mutagène de la metformine dans les tests in vitro suivants: test d'Ames (S. typhimurium), test de mutation génique (cellules de lymphome de souris) ou test d'aberrations chromosomiques (lymphocytes humains). Les résultats du test du micronoyau de souris in vivo étaient également négatifs. La fertilité des rats mâles ou femelles n'a pas été affectée par la metformine lorsqu'elle a été administrée à des doses pouvant atteindre 600 mg / kg / jour, qui est environ trois fois la dose quotidienne maximale recommandée chez l'homme en fonction de la surface corporelle comparaisons.
Haut
Etudes cliniques
La co-administration de sitagliptine et de metformine a été étudiée chez des patients atteints de diabète de type 2 insuffisamment contrôlés par l'alimentation et l'exercice et en association avec le glimépiride.
Aucune étude d'efficacité clinique n'a été menée avec Janumet; cependant, la bioéquivalence de Janumet avec des comprimés de sitagliptine et de chlorhydrate de metformine co-administrés a été démontrée.
Co-administration de sitagliptine et de metformine chez les patients atteints de diabète de type 2 mal contrôlés en matière d'alimentation et d'exercice
Au total, 1091 patients atteints de diabète de type 2 et d'un contrôle glycémique inadéquat de l'alimentation et de l'exercice ont participé à une étude factorielle randomisée, en double aveugle, contrôlée contre placebo, conçue pour évaluer l'efficacité de la sitagliptine et de la metformine co-administration. Les patients sous antihyperglycémiant (N = 541) ont subi un régime alimentaire, de l'exercice et une période de sevrage médicamenteux d'une durée allant jusqu'à 12 semaines. Après la période de sevrage, les patients avec un contrôle glycémique insuffisant (A1C 7,5% à 11%) ont été randomisés après avoir terminé une période de rodage de placebo en simple aveugle de 2 semaines. Patients non sous antihyperglycémiants à l'entrée de l'étude (N = 550) avec un contrôle glycémique insuffisant (A1C 7,5% à 11%) sont immédiatement entrés dans la période de rodage du placebo en simple aveugle de 2 semaines, randomisé. Un nombre approximativement égal de patients a été randomisé pour recevoir un placebo, 100 mg de sitagliptine une fois par jour, 500 mg ou 1000 mg de metformine deux fois par jour, ou 50 mg de sitagliptine deux fois par jour en association avec 500 mg ou 1000 mg de metformine deux fois du quotidien. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours de l'étude ont été traités par sauvetage au glyburide (glibenclamide).
La co-administration de sitagliptine et de metformine a fourni des améliorations significatives de l'A1C, du FPG et du PPG sur 2 heures par rapport au placebo, à la metformine seule et à la sitagliptine seule (tableau 3, figure 1). Les réductions moyennes par rapport à la valeur initiale de l'A1C étaient généralement plus importantes pour les patients présentant des valeurs A1C de base plus élevées. Pour les patients qui ne prenaient pas d'antihyperglycémiant à l'entrée dans l'étude, les réductions moyennes par rapport à l'inclusion dans l'A1C étaient les suivantes: sitagliptine 100 mg une fois par jour, -1,1%; metformine 500 mg bid, -1,1%; metformine 1000 mg bid, -1,2%; sitagliptine 50 mg bid avec metformine 500 mg bid, -1,6%; sitagliptine 50 mg bid avec metformine 1000 mg bid, -1,9%; et pour les patients recevant un placebo, -0,2%. Les effets lipidiques étaient généralement neutres. La diminution du poids corporel dans les groupes recevant de la sitagliptine en association avec la metformine était similaire à celle des groupes recevant de la metformine seule ou un placebo.
Tableau 3: Paramètres glycémiques lors de la visite finale (étude de 24 semaines) pour la sitagliptine et la metformine, seuls et en association chez les patients atteints de diabète de type 2 insuffisamment contrôlés en matière d'alimentation et d'exercice *
Placebo |
Sitagliptine 100 mg QD |
Metformine 500 mg bid |
Metformine 1000 mg bid |
Sitagliptine 50 mg bid + Metformine 500 mg bid |
Sitagliptine 50 mg bid + Metformine 1000 mg bid |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Référence (moyenne) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Changement par rapport à la référence (moyenne ajustée†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Différence par rapport au placebo (moyenne ajustée†) (IC à 95%) |
-0.8c (-1.1, -0.6) |
-1.0c (-1.2, -0.8) |
-1.3c (-1.5, -1.1) |
-1.6c (-1.8, -1.3) |
-2.1c (-2.3, -1.8) |
|
| Patients (%) atteignant A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % De patients recevant des médicaments de secours | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Référence (moyenne) | 196 | 201 | 205 | 197 | 204 | 197 |
| Changement par rapport à la référence (moyenne ajustée†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Différence par rapport au placebo (moyenne ajustée†) (IC à 95%) |
-23c (-33, -14) |
-33c (-43, -24) |
-35c (-45, -26) |
-53c (-62, -43) |
-70c (-79, -60) |
|
| PPG sur 2 heures (mg / dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Référence (moyenne) | 277 | 285 | 293 | 283 | 292 | 287 |
| Changement par rapport à la référence (moyenne ajustée†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Différence par rapport au placebo (moyenne ajustée†) (IC à 95%) |
-52c (-67, -37) |
-54c (-69, -39) |
-78c (-93, -63) |
-93c (-107, -78) |
-117c (-131, -102) |
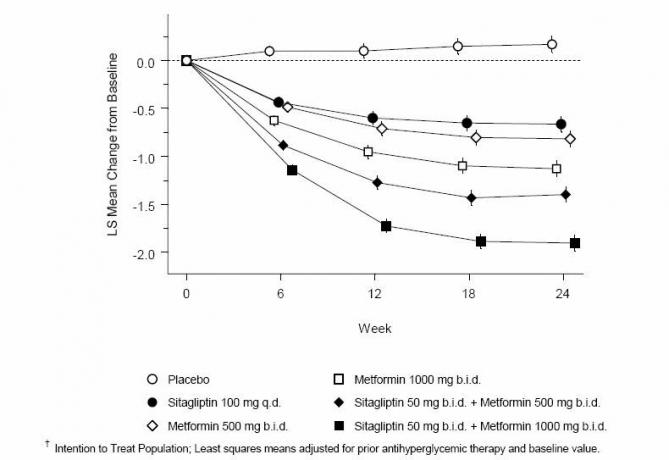
Figure 1: Variation moyenne par rapport à l'inclusion de l'A1C (%) sur 24 semaines avec la sitagliptine et la metformine, seules et en association chez les patients atteints de diabète de type 2 mal contrôlés par l'alimentation et l'exercice…
De plus, cette étude a inclus des patients (N = 117) avec une hyperglycémie plus sévère (A1C> 11% ou sang glucose> 280 mg / dL) qui ont été traités avec de la sitagliptine en ouvert deux fois par jour 50 mg et de la metformine 1000 mg. Dans ce groupe de patients, la valeur moyenne initiale de l'A1C était de 11,2%, la FPG moyenne était de 314 mg / dL et la PPG moyenne sur 2 heures était de 441 mg / dL. Après 24 semaines, des diminutions moyennes par rapport à l'inclusion de -2,9% pour A1C, -127 mg / dL pour FPG et -208 mg / dL pour PPG sur 2 heures ont été observées.
Le traitement d'association initial ou le maintien du traitement d'association doit être personnalisé et laissé à la discrétion du professionnel de la santé.
Traitement complémentaire à la sitagliptine chez les patients atteints de diabète de type 2 insuffisamment contrôlé par la metformine seule
Au total, 701 patients atteints de diabète de type 2 ont participé à une étude randomisée, en double aveugle, contrôlée contre placebo, d'une durée de 24 semaines, conçue pour évaluer l'efficacité de la sitagliptine en association avec la metformine. Les patients déjà sous metformine (N = 431) à une dose d'au moins 1500 mg par jour ont été randomisés après avoir terminé une période de rodage de placebo en simple aveugle de 2 semaines. Patients sous metformine et un autre antihyperglycémiant (N = 229) et patients sous aucun antihyperglycémiant (hors traitement pendant au moins 8 semaines, N = 41) ont été randomisés après une période de rodage d'environ 10 semaines sous metformine (à une dose d'au moins 1500 mg par jour) monothérapie. Les patients ont été randomisés pour l'ajout de 100 mg de sitagliptine ou d'un placebo, administrés une fois par jour. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours des études ont été traités par pioglitazone.
En association avec la metformine, la sitagliptine a apporté des améliorations significatives en A1C, FPG et PPG sur 2 heures par rapport au placebo avec la metformine (tableau 4). Un traitement glycémique de secours a été utilisé chez 5% des patients traités par 100 mg de sitagliptine et 14% des patients traités par placebo. Une diminution similaire du poids corporel a été observée pour les deux groupes de traitement.
Tableau 4: Paramètres glycémiques lors de la visite finale (étude de 24 semaines) de la sitagliptine en association avec la metformine *
| Sitagliptine 100 mg QD + Metformine |
Placebo + Metformine |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Référence (moyenne) | 8.0 | 8.0 |
| Changement par rapport à la référence (moyenne ajustée†) | -0.7 | -0.0 |
| Différence par rapport au placebo + metformine (moyenne ajustée†) (IC à 95%) |
-0.7c (-0.8, -0.5) |
|
| Patients (%) atteignant A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Référence (moyenne) | 170 | 174 |
| Changement par rapport à la référence (moyenne ajustée†) | -17 | 9 |
| Différence par rapport au placebo + metformine (moyenne ajustée†) (IC à 95%) |
-25c (-31, -20) |
|
| PPG sur 2 heures (mg / dL) | N = 387 | N = 182 |
| Référence (moyenne) | 275 | 272 |
| Changement par rapport à la référence (moyenne ajustée†) | -62 | -11 |
| Différence par rapport au placebo + metformine (moyenne ajustée†) (IC à 95%) |
-51c (-61, -41) |
Thérapie Complémentaire à La Sitagliptine Chez Les Patients Atteints De Diabète De Type 2 Maîtrisé De Façon Insuffisante Sur La Combinaison De La Metformine Et Du Glimépiride
Au total, 441 patients atteints de diabète de type 2 ont participé à un essai randomisé en double aveugle de 24 semaines, étude contrôlée contre placebo conçue pour évaluer l'efficacité de la sitagliptine en association avec le glimépiride, avec ou sans metformine. Les patients sont entrés dans une période de traitement de base avec du glimépiride (4 mg ¥ par jour) seul ou du glimépiride en association avec de la metformine (1 500 mg ¥ par jour). Après une période de titration de dose et de rodage stable jusqu'à la dose allant jusqu'à 16 semaines et une période de rodage de 2 semaines avec le placebo, les patients le contrôle glycémique (A1C 7,5% à 10,5%) a été randomisé pour l'ajout de 100 mg de sitagliptine ou d'un placebo, administrés une fois du quotidien. Les patients qui n'ont pas atteint leurs objectifs glycémiques spécifiques au cours des études ont été traités par pioglitazone.
Les patients recevant de la sitagliptine avec de la metformine et du glimépiride ont présenté des améliorations significatives de l'A1C et du FPG par rapport aux patients recevant placebo avec metformine et glimépiride (tableau 5), avec des réductions moyennes par rapport au placebo par rapport à un placebo en A1C de -0,9% et en FPG de -21 mg / dL. Un traitement de secours a été utilisé chez 8% des patients traités par 100 mg de sitagliptine et 29% des patients traités avec un placebo complémentaire. Les patients traités avec de la sitagliptine supplémentaire ont présenté une augmentation moyenne de 1,1 kg du poids corporel par rapport à placebo supplémentaire (+0,4 kg vs -0,7 kg). De plus, la sitagliptine ajoutée a entraîné une augmentation du taux d'hypoglycémie par rapport au placebo supplémentaire. [Voir Avertissements et precautions; Effets indésirables.]
Tableau 5: Paramètres glycémiques lors de la visite finale (étude de 24 semaines) pour la sitagliptine en association avec la metformine et le glimépiride *
| Sitagliptine 100 mg + Metformine et glimépiride |
Placebo + Metformine et glimépiride |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Référence (moyenne) | 8.3 | 8.3 |
| Changement par rapport à la référence (moyenne ajustée†) | -0.6 | 0.3 |
| Différence par rapport au placebo (moyenne ajustée†) (IC à 95%) | -0.9c (-1.1, -0.7) |
|
| Patients (%) atteignant A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Référence (moyenne) | 179 | 179 |
| Changement par rapport à la référence (moyenne ajustée†) | -8 | 13 |
| Différence par rapport au placebo (moyenne ajustée†) (IC à 95%) | -21c (-32, -10) |
Thérapie complémentaire à la sitagliptine vs Thérapie complémentaire au glipizide chez les patients atteints de diabète de type 2 insuffisamment contrôlé par la metformine
L'efficacité de la sitagliptine a été évaluée dans un essai de non-infériorité contrôlé par glipizide en double aveugle de 52 semaines chez des patients atteints de diabète de type 2. Les patients non traités ou sous d'autres antihyperglycémiants sont entrés dans une période de traitement préliminaire d'une durée allant jusqu'à 12 semaines avec la metformine en monothérapie (dose de 1500 ¥ 1500 mg par jour) qui comprenait l'élimination des médicaments autres que la metformine, si en vigueur. Après la période de rodage, ceux dont le contrôle glycémique était insuffisant (A1C 6,5% à 10%) ont été randomisés 1: 1 pour ajouter 100 mg de sitagliptine une fois par jour ou du glipizide pendant 52 semaines. Les patients recevant du glipizide ont reçu une posologie initiale de 5 mg / jour, puis ont été titrés électivement au cours des 18 semaines suivantes jusqu'à une posologie maximale de 20 mg / jour au besoin pour optimiser le contrôle glycémique. Par la suite, la dose de glipizide devait être maintenue constante, à l'exception de la sous-titration pour prévenir l'hypoglycémie. La dose moyenne de glipizide après la période de titration était de 10 mg.
Après 52 semaines, la sitagliptine et le glipizide présentaient des réductions moyennes similaires par rapport aux valeurs initiales de l'A1C dans l'analyse en intention de traiter (tableau 6). Ces résultats étaient cohérents avec l'analyse par protocole (figure 2). Une conclusion en faveur de la non-infériorité de la sitagliptine au glipizide peut être limitée aux patients avec A1C comparable à ceux inclus dans l'étude (plus de 70% des patients avaient A1C <8% au départ et plus de 90% avaient A1C <9%).
Tableau 6: Paramètres glycémiques dans une étude de 52 semaines comparant la sitagliptine au glipizide en tant que thérapie complémentaire chez des patients insuffisamment contrôlés par la metformine (population en intention de traiter) *
| Sitagliptine 100 mg + Metformine |
Glipizide + Metformine |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Référence (moyenne) | 7.7 | 7.6 |
| Changement par rapport à la référence (moyenne ajustée†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Référence (moyenne) | 166 | 164 |
| Changement par rapport à la référence (moyenne ajustée†) | -8 | -8 |
Figure 2: Variation moyenne par rapport à l'inclusion de l'A1C (%) sur 52 semaines dans une étude comparant la sitagliptine à Glipizide en tant que thérapie complémentaire chez les patients insuffisamment contrôlés par la metformine (population par protocole) â€
L'incidence de l'hypoglycémie dans le groupe sitagliptine (4,9%) était significativement (p <0,001) inférieure à celle du groupe glipizide (32,0%). Les patients traités par la sitagliptine ont présenté une diminution moyenne significative du poids corporel par rapport à la prise de poids significative chez les patients ayant reçu du glipizide (-1,5 kg par rapport à +1,1 kg).
Haut
Comment fournie
N ° 6747 - Comprimés Janumet, 50 mg / 500 mg, sont des comprimés pelliculés rose pâle, en forme de capsule, portant l'inscription «575» gravée sur une face. Ils sont fournis comme suit:
NDC 0006-0575-61 flacons d'unité d'utilisation de 60
NDC 0006-0575-62 bouteilles d'unité d'utilisation de 180
NDC 0006-0575-52 plaquettes thermoformées unidoses de 50
NDC 0006-0575-82 bouteilles en vrac de 1000.
N ° 6749 - Comprimés Janumet, 50 mg / 1000 mg, sont des comprimés pelliculés rouges, en forme de capsule, portant l'inscription «577» gravée sur une face. Ils sont fournis comme suit:
NDC 0006-0577-61 bouteilles d'unité d'utilisation de 60
NDC 0006-0577-62 bouteilles d'unité d'utilisation de 180
NDC 0006-0577-52 plaquettes thermoformées unidoses de 50
NDC 0006-0577-82 bouteilles en vrac de 1000.
Conserver à 20-25 ° C (68-77 ° F), excursions permises à 15-30 ° C (59-86 ° F).
Haut
Information sur le counseling des patients
Instructions
Les patients doivent être informés des risques et avantages potentiels de Janumet et des modes alternatifs de thérapie. Ils devraient également être informés de l'importance du respect des instructions diététiques, de l'activité physique régulière, du sang périodique surveillance de la glycémie et tests A1C, reconnaissance et prise en charge de l'hypoglycémie et de l'hyperglycémie, et évaluation du diabète complications. Pendant les périodes de stress telles que fièvre, traumatisme, infection ou chirurgie, les besoins en médicaments peuvent changer et les patients doivent être avisés de consulter rapidement un médecin.
Les risques d'acidose lactique dus au composant metformine, à ses symptômes et aux conditions qui prédisposent à son développement, comme indiqué dans Avertissements et precautions, doit être expliqué aux patients. Il faut conseiller aux patients d'arrêter immédiatement Janumet et d'aviser rapidement leur médecin en cas d'hyperventilation inexpliquée, de myalgie, malaise, somnolence inhabituelle, étourdissements, battements cardiaques lents ou irréguliers, sensation de sensation de froid (surtout aux extrémités) ou autres symptômes non spécifiques se produire. Les symptômes gastro-intestinaux sont courants lors de l'initiation du traitement par metformine et peuvent survenir lors de l'initiation du traitement par Janumet; cependant, les patients doivent consulter leur médecin s'ils développent des symptômes inexpliqués. Bien qu'il soit peu probable que les symptômes gastro-intestinaux qui surviennent après stabilisation soient liés au médicament, la survenue de symptômes doit être évaluée pour déterminer si elle peut être due à une acidose lactique ou à d'autres maladie.
Les patients doivent être déconseillés de consommer trop d'alcool, aigu ou chronique, pendant qu'ils reçoivent Janumet.
Les patients doivent être informés de l'importance de tester régulièrement la fonction rénale et les paramètres hématologiques lors du traitement par Janumet.
Les patients doivent être informés que des réactions allergiques ont été rapportées lors de l'utilisation après commercialisation de la sitagliptine, l'un des composants de Janumet. Si des symptômes de réactions allergiques (y compris éruption cutanée, urticaire et enflure du visage, des lèvres, de la langue et de la gorge qui peuvent provoquer des difficultés à respirer ou à avaler), les patients doivent arrêter de prendre Janumet et consulter un médecin rapidement.
Les médecins doivent demander à leurs patients de lire la notice du patient avant de commencer le traitement par Janumet et de relire chaque fois que l'ordonnance est renouvelée. Les patients doivent être informés d'informer leur médecin ou leur pharmacien s'ils développent un symptôme inhabituel, ou si un symptôme connu persiste ou s'aggrave.
Tests de laboratoire
La réponse à toutes les thérapies diabétiques doit être surveillée par des mesures périodiques de la glycémie et des niveaux d'A1C, dans le but de réduire ces niveaux vers la plage normale. L'A1C est particulièrement utile pour évaluer le contrôle glycémique à long terme.
Surveillance initiale et périodique des paramètres hématologiques (p. Ex. Hémoglobine / hématocrite et sang rouge indices cellulaires) et la fonction rénale (créatininémie) doivent être effectuées, au moins une fois par an. Bien que l'anémie mégaloblastique ait rarement été observée avec un traitement par metformine, si cela est suspecté, une carence en vitamine B12 doit être exclue.
Distribué par:
MERCK & CO., INC., Whitehouse Station, NJ 08889, États-Unis
9794108
Brevet américain n °: 6 699 871
1 Marque déposée de MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
2 Marque déposée de MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
3GLUCOPHAGE® est une marque déposée de Merck Sante S.A.S, un associé de Merck KGaA de Darmstadt, en Allemagne.
Sous licence à Bristol-Myers Squibb Company.
COPYRIGHT © 2007, 2008 MERCK & CO., Inc.
Tous les droits sont réservés
Étiquetage des patients approuvé par la FDA
Information patient
Janumet® (JAN-vous-rencontré)
(sitagliptine / metformine HCl)
Comprimés
Lisez les informations patient fournies avec Janumet1 avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Cette notice ne tient pas lieu de parler à votre médecin de votre état de santé ou de votre traitement.
Quelles sont les informations les plus importantes que je devrais connaître sur Janumet?
Le chlorhydrate de metformine, l'un des ingrédients de Janumet, peut provoquer un effet secondaire rare mais grave appelé acidose lactique (une accumulation d'acide lactique dans le sang) qui peut entraîner la mort. L'acidose lactique est une urgence médicale et doit être traitée dans un hôpital.
Arrêtez de prendre Janumet et appelez immédiatement votre médecin si vous présentez l'un des symptômes suivants de l'acidose lactique:
- Vous vous sentez très faible et fatigué.
- Vous avez des douleurs musculaires inhabituelles (pas normales).
- Vous avez du mal à respirer.
- Vous avez des problèmes d'estomac ou d'intestin inexpliqués avec des nausées et des vomissements, ou de la diarrhée.
- Vous avez froid, surtout dans vos bras et vos jambes.
- Vous vous sentez étourdi ou étourdi.
- Vous avez un rythme cardiaque lent ou irrégulier.
Vous avez plus de chances d'obtenir une acidose lactique si vous:
- avez des problèmes rénaux.
- avez des problèmes de foie.
- avez une insuffisance cardiaque congestive qui nécessite un traitement médicamenteux.
- boire beaucoup d'alcool (très souvent ou à court terme "binge" potable).
- se déshydrater (perdre une grande quantité de liquides organiques). Cela peut se produire si vous avez de la fièvre, des vomissements ou de la diarrhée. La déshydratation peut également survenir lorsque vous transpirez beaucoup en faisant de l'exercice ou en faisant de l'exercice et que vous ne buvez pas suffisamment de liquides.
- subir certains tests radiographiques avec des colorants injectables ou des agents de contraste.
- Subir une opération chirurgicale.
- avez une crise cardiaque, une infection grave ou un accident vasculaire cérébral.
- avez 80 ans ou plus et n'avez pas subi de test de la fonction rénale.
Qu'est-ce que Janumet?
Les comprimés de Janumet contiennent deux médicaments sur ordonnance, la sitagliptine (JANUVIA ™ 2) et la metformine. Janumet peut être utilisé avec un régime alimentaire et de l'exercice pour abaisser la glycémie chez les patients adultes atteints de diabète de type 2. Votre médecin déterminera si Janumet vous convient et déterminera la meilleure façon de commencer et de continuer à traiter votre diabète.
Janumet:
- aide à améliorer les niveaux d'insuline après un repas.
- aide le corps à mieux répondre à l'insuline qu'il produit naturellement.
- diminue la quantité de sucre produite par le corps.
- est peu susceptible de provoquer une hypoglycémie (hypoglycémie) lorsqu'il est pris seul pour traiter une glycémie élevée.
Janumet n'a pas été étudié chez les enfants de moins de 18 ans.
Janumet n'a pas été étudié avec l'insuline, un médicament connu pour provoquer une hypoglycémie.
Qui ne devrait pas prendre Janumet?
Ne prenez jamais Janumet si vous:
- souffrez de diabète de type 1.
- avez certains problèmes rénaux.
- avez des conditions appelées acidose métabolique ou acidocétose diabétique (augmentation des cétones dans le sang ou l'urine).
- avez eu une réaction allergique à Janumet ou à la sitagliptine (JANUVIA), l'un des composants de Janumet.
- vont recevoir une injection de colorant ou d'agents de contraste pour une procédure aux rayons X, Janumet devra être arrêté pendant une courte période. Demandez à votre médecin quand arrêter Janumet et quand recommencer. Voir "Quelles sont les informations les plus importantes que je devrais connaître sur Janumet?"
Que dois-je dire à mon médecin avant et pendant le traitement par Janumet?
Janumet peut ne pas vous convenir. Informez votre médecin de toutes vos conditions médicales, y compris si vous:
- avez des problèmes rénaux.
- avez des problèmes de foie.
- avez eu une réaction allergique à Janumet ou à la sitagliptine (JANUVIA), l'un des composants de Janumet.
- avez des problèmes cardiaques, y compris une insuffisance cardiaque congestive.
- ont plus de 80 ans. Les patients de plus de 80 ans ne doivent pas prendre Janumet sauf si leur fonction rénale est vérifiée et si elle est normale.
- boire beaucoup d'alcool (tout le temps ou une consommation excessive d'alcool à court terme).
- êtes enceinte ou prévoyez de devenir enceinte. On ne sait pas si Janumet nuira à votre bébé à naître. Si vous êtes enceinte, discutez avec votre médecin de la meilleure façon de contrôler votre glycémie pendant votre grossesse. Si vous utilisez Janumet pendant la grossesse, discutez avec votre médecin de la façon dont vous pouvez figurer sur le registre Janumet. Le numéro de téléphone sans frais pour le registre des grossesses est le 1-800-986-8999.
- vous allaitez ou prévoyez d'allaiter. On ne sait pas si Janumet passera dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez Janumet.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Janumet peut affecter l'efficacité des autres médicaments et certains médicaments peuvent affecter l'efficacité de Janumet.
Connaissez les médicaments que vous prenez. Gardez une liste de vos médicaments et montrez-la à votre médecin et à votre pharmacien lorsque vous recevez un nouveau médicament. Parlez-en à votre médecin avant de commencer tout nouveau médicament.
Comment devrais-je prendre Janumet?
- Votre médecin vous dira combien de comprimés Janumet vous devez prendre et à quelle fréquence vous devez les prendre. Prenez Janumet exactement comme votre médecin vous l'a indiqué.
- Votre médecin devra peut-être augmenter votre dose pour contrôler votre glycémie.
- Votre médecin peut vous prescrire Janumet avec une sulfonylurée (un autre médicament pour abaisser la glycémie). Voir "Quels sont les effets secondaires possibles de Janumet?" pour plus d'informations sur le risque accru d'hypoglycémie.
- Prenez Janumet au cours des repas pour réduire vos risques de maux d'estomac.
- Continuez à prendre Janumet aussi longtemps que votre médecin vous l'a indiqué.
- Si vous avez pris trop de Janumet, appelez immédiatement votre médecin ou un centre anti-poison.
- Si vous manquez une dose, prenez-la avec de la nourriture dès que vous vous en souvenez. Si vous ne vous en souvenez pas avant l'heure de votre prochaine dose, sautez la dose oubliée et reprenez votre programme habituel. Ne prenez pas deux doses de Janumet en même temps.
- Vous devrez peut-être arrêter de prendre Janumet pendant une courte période. Appelez votre médecin pour obtenir des instructions si vous:
- sont déshydratés (ont perdu trop de liquide corporel). Une déshydratation peut survenir si vous êtes malade avec des vomissements sévères, de la diarrhée ou de la fièvre, ou si vous buvez beaucoup moins de liquide que la normale.
- prévoyez une intervention chirurgicale.
- vont recevoir une injection de colorant ou d'agent de contraste pour une procédure aux rayons X.
Voir "Quelles sont les informations les plus importantes que je devrais connaître sur Janumet?" et "Qui ne devrait pas prendre Janumet?"
- Lorsque votre corps est soumis à certains types de stress, comme la fièvre, un traumatisme (comme un accident de voiture), une infection ou une intervention chirurgicale, la quantité de médicaments contre le diabète dont vous avez besoin peut changer. Informez immédiatement votre médecin si vous avez l'une de ces conditions et suivez les instructions de votre médecin.
- Surveillez votre glycémie selon les directives de votre médecin.
- Restez sur votre régime et programme d'exercice prescrits tout en prenant Janumet.
- Discutez avec votre médecin de la façon de prévenir, de reconnaître et de gérer une glycémie basse (hypoglycémie), une glycémie élevée (hyperglycémie) et les complications du diabète.
- Votre médecin surveillera votre diabète avec des tests sanguins réguliers, y compris votre glycémie et votre hémoglobine A1C.
- Votre médecin effectuera des analyses de sang pour vérifier votre fonction rénale avant et pendant le traitement par Janumet.
Quels sont les effets secondaires possibles de Janumet?
Janumet peut provoquer des effets secondaires graves. Voir "Quelles sont les informations les plus importantes que je devrais connaître sur Janumet?"
Les effets secondaires courants lors de la prise de Janumet comprennent:
- nez bouché ou qui coule et mal de gorge
- infection respiratoire supérieure
- la diarrhée
- nausée et vomissements
- gaz, gêne gastrique, indigestion
- la faiblesse
- mal de crâne
La prise de Janumet avec les repas peut aider à réduire les effets secondaires gastriques courants de la metformine qui surviennent généralement au début du traitement. Si vous avez des problèmes d'estomac inhabituels ou inattendus, parlez-en à votre médecin. Les problèmes d'estomac qui se manifestent plus tard pendant le traitement peuvent être le signe de quelque chose de plus grave.
Certains médicaments contre le diabète, tels que les sulfonylurées et les méglitinides, peuvent provoquer une hypoglycémie (hypoglycémie). Lorsque Janumet est utilisé avec ces médicaments, votre glycémie peut être trop faible. Votre médecin peut vous prescrire des doses plus faibles de sulfonylurée ou de méglitinide. Informez votre médecin si vous avez des problèmes d'hypoglycémie.
Les effets indésirables supplémentaires suivants ont été rapportés en utilisation générale avec Janumet ou la sitagliptine:
- Des réactions allergiques graves peuvent survenir avec Janumet ou la sitagliptine, l'un des médicaments contenus dans Janumet. Les symptômes d'une réaction allergique grave peuvent inclure une éruption cutanée, de l'urticaire et un gonflement du visage, des lèvres, de la langue et de la gorge, des difficultés à respirer ou à avaler. Si vous avez une réaction allergique, arrêtez de prendre Janumet et appelez immédiatement votre médecin. Votre médecin peut vous prescrire un médicament pour traiter votre réaction allergique et un autre médicament pour votre diabète.
- Enzymes hépatiques élevées.
- Inflammation du pancréas.
Ce ne sont pas tous les effets secondaires possibles de Janumet. Pour plus d'informations, demandez à votre médecin.
Informez votre médecin si vous avez un effet indésirable qui vous dérange, est inhabituel ou ne disparaît pas.
Comment dois-je conserver Janumet?
Conservez Janumet à la température ambiante, 68-77 ° F (20-25 ° C).
Gardez Janumet et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation de Janumet
Les médicaments sont parfois prescrits pour des affections qui ne sont pas mentionnées dans les brochures d'information destinées aux patients. N'utilisez pas Janumet pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas Janumet à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela pourrait leur être nocif.
Cette brochure résume les informations les plus importantes sur Janumet. Si vous souhaitez en savoir plus, parlez-en à votre médecin. Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur Janumet destinées aux professionnels de la santé. Pour plus d'informations, composez le 1-800-622-4477.
Quels sont les ingrédients de Janumet?
Ingrédients actifs: sitagliptine et chlorhydrate de metformine.
Ingrédients inactifs: cellulose microcristalline, polyvinylpyrrolidone, laurylsulfate de sodium et stéaryl fumarate de sodium. Le film pelliculé contient les ingrédients inactifs suivants: alcool polyvinylique, polyéthylène glycol, talc, dioxyde de titane, oxyde de fer rouge et oxyde de fer noir.
Qu'est-ce que le diabète de type 2?
Le diabète de type 2 est une condition dans laquelle votre corps ne produit pas suffisamment d'insuline et l'insuline que votre corps produit ne fonctionne pas aussi bien qu'il le devrait. Votre corps peut également produire trop de sucre. Lorsque cela se produit, du sucre (glucose) s'accumule dans le sang. Cela peut entraîner de graves problèmes médicaux.
Le principal objectif du traitement du diabète est d'abaisser votre glycémie à un niveau normal. L'abaissement et le contrôle de la glycémie peuvent aider à prévenir ou à retarder les complications du diabète, telles que les problèmes cardiaques, les problèmes rénaux, la cécité et l'amputation.
Une glycémie élevée peut être abaissée par l'alimentation et l'exercice, et par certains médicaments si nécessaire.
Publié en mars 2009
Distribué par:
MERCK & CO., INC., Whitehouse Station, NJ 08889, États-Unis
Dernière mise à jour: 03/09
Janumet, Sitagliptin and Metformin Hydrochloride, Information pour les patients (en anglais simple)
Informations détaillées sur les signes, les symptômes, les causes et les traitements du diabète
Les informations contenues dans cette monographie ne sont pas destinées à couvrir toutes les utilisations, directions, précautions, interactions médicamenteuses ou effets indésirables possibles. Ces informations sont généralisées et ne sont pas destinées à un avis médical spécifique. Si vous avez des questions sur les médicaments que vous prenez ou si vous souhaitez plus d'informations, consultez votre médecin, votre pharmacien ou votre infirmière.
retour à: Parcourir tous les médicaments pour le diabète


